
����Ŀ��Ϊ�����Ž��з�����Ԫ�����ڱ�����150���꣬���Ϲ��������2019��Ϊ�����ʻ�ѧԪ�����ڱ�������IYPT2019����Ԫ�����ڱ��������������Ϣ���ɣ��������漰��Ԫ�ؾ�Ϊ��ѧ��ѧ����������Ԫ��(����ĸx�ȱ�ʾ)ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ������˵������ȷ����

A.Ԫ�����ڱ���7�����ڣ�16���壬����118��Ԫ�أ��������ǽ���Ԫ��
B.x��e��ɵĻ������������ӻ�����û�������н�ǿ�Ļ�ԭ��
C.d��f��g��h�����Ӱ뾶˳��g��h��d��f
D.y��z��h������⻯��ķе�h��z��y
���𰸡�D
��������
���ڶ�����Ԫ�أ�x��e�ԣ�1�ۣ�λ��IA�壬y�ԣ�4�ۣ�λ��IVA�壬z�ԣ�5�ۣ�λ��VA�壬d��g�ԣ�2�ۣ�λ��VIA��f�ԣ�3�ۣ�λ��IIIA�壬h�ԣ�1�ۣ�λ��VIIA�壬ͬ���ڴ�������ԭ�Ӱ뾶���μ�С��ͬ������ϵ���ԭ�Ӱ뾶������ͼ����Ϣ�������ƶϳ�x��H��y��C��z��N��d��O��e��Na��f��Al��g��S��h��Cl���ݴ˷�����
���ڶ�����Ԫ�أ�x��e�ԣ�1�ۣ�λ��IA�壬y�ԣ�4�ۣ�λ��IVA�壬z�ԣ�5�ۣ�λ��VA�壬d��g�ԣ�2�ۣ�λ��VIA��f�ԣ�3�ۣ�λ��IIIA�壬h�ԣ�1�ۣ�λ��VIIA�壬ͬ���ڴ�������ԭ�Ӱ뾶���μ�С��ͬ������ϵ���ԭ�Ӱ뾶������ͼ����Ϣ�������ƶϳ�x��H��y��C��z��N��d��O��e��Na��f��Al��g��S��h��Cl��
A. Ԫ�����ڱ���7���б�ʾ7�����ڣ�18���б�ʾ16���壨IA-VIIA��IB-VIIB��VIII��8��9��10�У���0�壩��2+8+8+18+18+32+32����118��Ԫ�أ����ǽ���Ԫ�ؽ���80���֣���A˵����ȷ��
B. x��e�����NaH��NaH�����ӻ����NaH������-1�ۣ����NaH���н�ǿ�ĵĻ�ԭ�ԣ���B˵����ȷ��
C. d��f��g��h�����ӷֱ���O2-��Al3+��S2-��Cl-���ó�S2-��Cl-��O2-��Al3+����d��f��g��h�����Ӱ뾶˳��g��h��d��f����C˵����ȷ��
D. y��z��h������⻯��ֱ���CH4��NH3��HCl�����Ӿ���е�ĸ�����뷶�»����йأ�Ҫ�Ƚ����ǵķе�ߵͣ�һ���ȿ�����������������ٱȽ���Է���������NH3���Ӽ�������ܼ����������������NH3�е���ߣ����HCl����Է�������Ҫ��CH4��Է��������е�HCl����CH4�����NH3��HCl��CH4����y��z��h������⻯��ķе�z��h��y����D˵������
�𰸣�D



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ���ֶ����ڷǽ���Ԫ�ص�ԭ�Ӱ뾶��ԭ����������ͼ��ʾ�Ĺ�ϵ��������
���ֶ����ڷǽ���Ԫ�ص�ԭ�Ӱ뾶��ԭ����������ͼ��ʾ�Ĺ�ϵ��������![]() ��ˮú������Ҫ�ɷ�֮һ������˵������ȷ����
��ˮú������Ҫ�ɷ�֮һ������˵������ȷ����

A.![]() ������������Һ��Ӧ����������ʽ��
������������Һ��Ӧ����������ʽ��
B.![]() ��
��![]() �γɵĻ������к������Ӽ�
�γɵĻ������к������Ӽ�
C.![]() ��
��![]() ��
��![]() Ԫ�ص�����������Ӧˮ���������������ǿ
Ԫ�ص�����������Ӧˮ���������������ǿ
D.��Ԫ��![]() ��ԭ����������
��ԭ����������![]() ����
����![]() ͬ���壬��
ͬ���壬��![]() �Ľ�����ǿ��
�Ľ�����ǿ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ᶼ����Ҫ�Ĺ�ҵԭ�ϡ�
��1����״���£���500 L��������ˮ�γ�1 L��ˮ����˰�ˮ�����ʵ���Ũ��Ϊ__mol�� L-1��������λ��Ч���֣�����ҵ�ϳ��ù�����ˮ���ն������÷�Ӧ�Ļ�ѧ����ʽΪ__��
��2�����������ǹ�ҵ�����кϳ��������Ҫ;�����ϳɵĵ�һ���ǽ����Ϳ����Ļ����ͨ�����ȵIJ���Ͻ������ںϽ����Ĵ��£�����������һ���������÷�Ӧ�Ļ�ѧ����ʽΪ__��
���з�Ӧ�еİ��백�������еİ�������ͬ����__��
A��2Na+2NH3===2NaNH2+H2�� B��2NH3+3CuO===3Cu+N2+3H2O
C��4NH3+6NO===5N2+6H2O D��HNO3+NH3===NH4NO3
��ҵ�е�β��������ֻ��NO��NO2�����ռ�������գ���Ӧ�����ӷ���ʽΪ2NO2+2OH��===NO2-+NO3-+H2O��NO+NO2+2OH��===������+H2O����ƽ�÷���ʽ����______________
��3����27.2 g Cu��Cu2O�Ļ�����м���ijŨ�ȵ�ϡHNO3500 mL����Ӧ�����в���������ֻ��NO��������ȫ�ܽ����������Һ������������ֻ��Cu2+���м���1 L 1 mol��L-1��NaOH��Һʹ��������ǡ����ȫ��������ʱ��Һ�����ԣ����ó�������Ϊ39.2 g��
��Cu��ϡHNO3��Ӧ�����ӷ���ʽΪ__��
��Cu��Cu2O �����ʵ���֮��Ϊ__��
��HNO3�����ʵ���Ũ��Ϊ__mol��L-1��
��4����H2SO4��HNO3�Ļ����Һ20 mL������0.25 molL��1Ba��OH��2��Һʱ�����ɳ���������w��g����Ba��OH��2��Һ�����V��mL���Ĺ�ϵ��ͼ��ʾ��C ����Һ�����ԣ�����ԭ���Һ��H2SO4�����ʵ���Ũ��Ϊ__mol��L-1��HNO3�����ʵ���Ũ��Ϊ__mol��L-1��
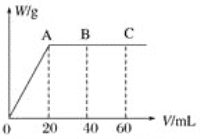
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����T ��ʱ��������(Ag2CrO4)��ˮ��Һ�еij����ܽ�ƽ��������ͼ��ʾ������˵���в���ȷ����

A����Ag2CrO4��Һ�м������K2CrO4��ʹ��Һ��Y���ΪX��
B��T��ʱ����Y���Z�㣬Ag2CrO4��Ksp���
C��T��ʱ��Ag2CrO4 �� Ksp��ֵΪ 1��10-11
D��ͼ��a=![]() ��10-4
��10-4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����![]() ���Ȼ���XCl2 0.95g�����Һ������1mol/L����������Һ20mL���ܰ���������ȫ�����������Լ��㣺
���Ȼ���XCl2 0.95g�����Һ������1mol/L����������Һ20mL���ܰ���������ȫ�����������Լ��㣺
(1)X��������Ϊ_________��
(2)��X�ĺ���������Ϊ12����47.5gXCl2���������ӵ����ʵ�����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ���л��м��壬��ũҩ��ҽҩ���������ϡ��۰��������Լ������϶���������;������������ˮ�⣬�۵�Ϊ��118��C���е�Ϊ8.2��C��ij����С��ģ�ҵ������һ����̼�������Ļ�����ڻ���̿����������������ȡ�������䷴Ӧԭ��Ϊ��Cl2��CO��COCl2��װ����ͼ��ʾ(�����ļ���װ����ʡ�ԣ�D�����������ռ�����)��
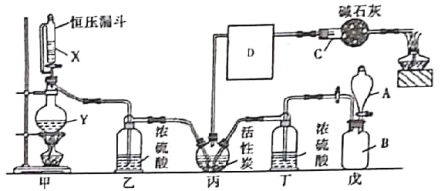
(1)����C������Ϊ___�����м�ʯ�ҵ�����Ϊ________________��D������Ӧ����_____(���ˮԡ������ˮԡ��)�С�
(2)������װ��ɺ����װ�������Եķ�����_________��
(3)��װ����Ҫ������ȡ������������KMnO4��������ȡ����ʱ�����ӷ���ʽΪ__________��
(4)��������ˮ�⣬��ˮ���ײ���һ���⻯���һ��������䷴Ӧ�Ļ�ѧ����ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�������Դ���⣬��ˮ�������õIJ��ֹ�����ͼ��ʾ�������й�˵������ȷ����( )

A.�ٴ����ƾ��γ����ù�����ɳ�⣬�������ȥ Ca2����Mg2����SO42-������
B.��ҵ�����г�ѡ��ʯ������Ϊ Mg2���ij����������Գ�������ϴ��
C.�ڢڲ��ķ�Ӧ�ǽ� MgCl26H2O �����ڿ�����ֱ�Ӽ�����ȥ�ᾧˮ����ˮ MgCl2
D.�ڢ۲����ڢݲ�������������ȡ��ˮ����ͨ��ʹ�� SO2 ����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϵԪ��������������Ԫ�أ�Fe3+������KSCN��Һ�����ӵȷ�����ɫ���á�þԪ��Ҳ�������������������Ԫ��֮һ�����ܹ�ά�ֺ���ṹ���ȶ��ԣ����ڻ������߹��ܣ�������ֿ��¹ڲ����Ȳ�����Ϯ������Ҫ���á�
��1��Fe3+�Ļ�̬��������Ų�ʽΪ____________________��
��2����SCN��Ϊ�ȵ�������Ϊ�Ǽ��Է��ӵĻ�ѧʽΪ_____________����дһ�֣���
��3����³ʿ���׳�������������ͼ����ʾ��K+δ��������ƽ��ÿ���������������к���һ��K+����֪�þ�������Ԫ����+2�ۺ�+3�����֣���Fe3+��Fe2+�ĸ�����Ϊ_________��


��4��Ѫ��������ͼ�ң�������ǿ�������������ʱ�һ��������3������ͼ���л���Fe2+��Nԭ�Ӽ�Ļ�ѧ����������λ������Ҫ�ü�ͷ���Ա�ʾ��______________


��5��þ���ʾ�����ԭ�ӵĶѻ�ģ����ͼ�����Ķѻ�ģ������Ϊ____________��������ͼ�е�_________________����a��b��c������λ����__________________�������������2acm3��þ���ʵ��ܶ�Ϊ��g��cm��3����֪������������ΪNA����þ��Ħ�������ļ���ʽ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ת��ָ���Ƿ�ӳ�ս��Ļ�еǿ�ȵ���������ָ�꣬��ֵԽ��еǿ��Խ�á�ij���ֳ��Ĺ�ҵ��������Ҫ����Al2O3��Fe2O3��SiO2���Ը÷������д�������ȡ���������������������£�

��1���ս�ʱ������Ҫ����MgO������ս�����ת��ָ������ͼ��ת��ָ����MgO�����Ĺ�ϵ���ߡ����ݴ�ͼ��֪�������˵�MgO������____%��

��2���ս������Ҫ��NaAlO2��Ca2SiO4��NaFeO2������X������X��____��
��3�����ǰ�轫�ս������з��飬��Ŀ����____����������У�NaFeO2����ˮ��Ӧ����NaOH��һ�ֺ����Ļ�����ú����Ļ�������____��
��4���ữʱ������Ӧ�����ӷ���ʽ��____��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com