
仅用下表提供的玻璃仪器(非玻璃仪器任选)不能实现相应实验目的的是
| 选项 | 实验目的 | 玻璃仪器 |
| A | 配制一定质量分数的NaCl溶液 | 胶头滴管、量筒、烧杯、玻璃棒 |
| B | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 |
| C | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 |
| D | 实验室用浓氨水和生石灰制备氨气 | 普通漏斗、烧杯、玻璃棒 |
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生
产中保持恒温恒容条件):
2SO2(g)+O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是
A.向装置中充入N2 B.向装置中充入过量的SO2
C.向装置中充入O2 D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及
固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一
反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g) 、3.5 mol O2
(g) 、1mol SO3 (g) ,下列说法正确的是
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
 D.第二次平衡时SO3的体积分数等于2/9
D.第二次平衡时SO3的体积分数等于2/9
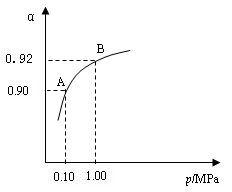
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。
A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是: ,并比较不同压强下的平衡常数:K(0.10 MPa)
K(1.0 MPa)(填 “<”或“>”或“=”)。
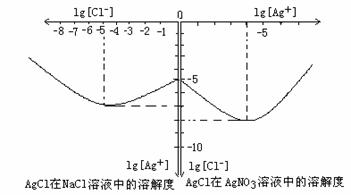 ⑷沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- = [AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
⑷沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- = [AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
①由图知该温度下AgCl的溶度积常数为 。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
查看答案和解析>>
科目:高中化学 来源: 题型:
某金属的硝酸盐受热分解生成N O2、O2和该金属的氧化物。已知NO2和O2的分子个数比为4:1,则在分解过程中该金属的化合价将(
O2、O2和该金属的氧化物。已知NO2和O2的分子个数比为4:1,则在分解过程中该金属的化合价将( )。
)。
A.无法确定 B.升高 C.不变 D.降低
查看答案和解析>>
科目:高中化学 来源: 题型:
镭是元素周期表中第ⅡA族元素,下列关于镭的叙述不正确的是( )
A. 镭比钙的金属性更强 B. 在化合物中是+2价
C. 镭是一种放射性元素 D. 氢氧化镭呈两性
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Co2O3在酸性溶液中易被还原成Co2+;Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A. 3Cl2+6FeI2=2FeCl3+4FeI3 B. Cl2+FeI2=FeCl2+I2
C. Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D. 2Fe2++ I2=2Fe3++2I-
D. 2Fe2++ I2=2Fe3++2I-
查看答案和解析>>
科目:高中化学 来源: 题型:
C、O、Na、Al、S、Cl是常见的六种元素
(1)C元素位于元素周期表第 周期,第 族;C元素的一种同位素可以测定文物年代,这种同位素的符号为
(2)用“大于”“小于”或“等于”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- Al3+ | H2SO4 HClO4 | O2- S2- | 35Cl 37Cl |
(3)① CaCO3和适量HCl溶液反应时,每产生4.4 g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示

请用离子方程式表示B-C段发生的反应:
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时
负极上的电极方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3 的浓度为0.6mol·L-1,请回答下列问题:
的浓度为0.6mol·L-1,请回答下列问题:
①用O2表示的反应的平均速率为_____________________________________
②平衡时SO2的转化率______________________________________
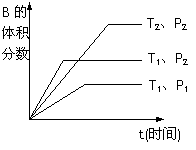 (2)已知某可逆反应mA(g)+nB(g)
(2)已知某可逆反应mA(g)+nB(g)  qC(g)在密闭容器中进行。
qC(g)在密闭容器中进行。
如图所示反应在不同时间t,温度T和压强P与反应物B的体积
分数的关系曲线。根据图象填空
①化学计量数的关系:m+n______q;(填“>”.“<”或“=”)
②该反应的正反应为___________反应。(填“吸热”或“放热”)
(3)在FeCl3+3KSCN Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡 ______________移动。
②在溶液中加入少量的KCl固体, 平衡 _____________移动。
平衡 _____________移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是
A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6KJ·mol-1,则氢气的燃烧热为241.8kJ·mol-1
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1);△H=-57.4kJ·mol-1则含 20.0gNaOH的稀溶液与稀醋酸完全中和,放出小于28.7kJ的热量
C.已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定
D.己知2C(s)+2O2(g)=2CO2(g);△H=akJ·mol-1、 2C(s)+O2(g)=2CO(g); △H= bkJ·mol-1,则a>b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com