
【题目】探究在常温下氢氧化钡晶体与氯化铵晶体反应过程中能量变化的实验方案和实验步骤如图所示,根据下面的实验方案和步骤回答下列问题:
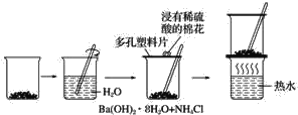
下表是某学生根据上述实验方案和步骤列表整理的实验事实和结论:
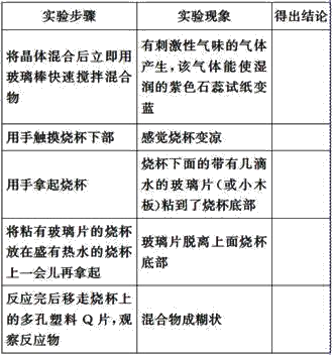
(1)请你根据实验现象得出相应的实验结论填入上表中。_________________。
(2)用化学方程式表示上述反应为_______________________。
【答案】 Ba(OH)2·8H2O+2NH4Cl=2NH3↑+ BaCl2+10H2O
Ba(OH)2·8H2O+2NH4Cl=2NH3↑+ BaCl2+10H2O
【解析】
(1)氢氧化钡晶体与氯化铵晶体反应过程中,产生了有刺激性气味的气体,能使紫色石蕊溶液变蓝的气体,为氨气;感觉烧杯变凉,则是吸热反应;烧杯与玻璃片中间的水温度降低结冰使玻璃片黏在烧杯上,反应吸收热量使体系温度降低,使水结成冰;放于热水的烧杯时,温度升高,冰融化了,所以玻璃片脱离;混合物呈糊状,说明生成了水;
(1)氢氧化钡晶体与氯化铵晶体反应过程中,产生了有刺激性气味的气体,能使紫色石蕊溶液变蓝的气体,为氨气;感觉烧杯变凉,则是吸热反应;烧杯与玻璃片中间的水温度降低结冰使玻璃片黏在烧杯上,反应吸收热量使体系温度降低,使水结成冰;放于热水的烧杯时,温度升高,冰融化了,所以玻璃片脱离;混合物呈糊状,说明生成了水;
故答案为: ;
;
(2) 根据实验现象,写出化学方程式Ba(OH)2·8H2O+2NH4Cl=2NH3↑+ BaCl2+10H2O,
故答案为Ba(OH)2·8H2O+2NH4Cl=2NH3↑+ BaCl2+10H2O;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】食品保鲜膜按材质分别为聚乙烯 (PE )、聚氯乙烯 (PVC )、聚偏二氯乙烯 (PVDC )等种类。 其中 PE 和 PVDC 是安全的。PVC 对人体的潜在危害主要来源于两个方面:产品中氯乙烯单体残留量、加工过程中使用的加工助剂的种类及含量。
(1)写出用乙烯、氯乙烯分别生产聚乙烯和聚氯乙烯的化学方程式:乙烯→聚乙烯 (PE ):_____ 氯乙烯→聚氯乙烯 (PVC ):_____ 日常用的食品保鲜膜宜选用_____。
(2)目前出现的“不粘锅”、不粘油的吸油烟机等新型厨具,其秘密就是表面有一种叫做“特富龙”的涂层,实际上就是被称为“塑料王”的聚四氟乙烯。它的单体四氟乙烯的结构简式是_____,合成特富龙的反应类型是_____,反应方程式为_____。
(3)聚四氟乙烯的发现源于一次实验意外。1938 年,化学家普鲁凯特与助手们研究四氟乙烯的聚合反应,他们将四氟乙烯贮存在冷藏箱中的加压钢瓶中,当将钢瓶与反应器管道、反应器 (管道 及反应器间隙有空气 )接通后,发生故障,四氟乙烯气体并没有通到反应器中,经称重证明钢瓶中气体一点没减少,打开阀门也没有四氟乙烯气体逸出,但拆卸阀门后却从钢瓶倒出与四氟乙烯等重的白色粉末,即四氟乙烯已在钢瓶中发生了聚合反应。后经确证,该白色粉末就是聚四氟乙烯。1945 年,美国杜邦公司开始在工业规模上生产聚四氟乙烯,由此可以推知该反应的条件是_____、_____、_____引发。
(4 )不粘锅的内壁有一薄层聚四氟乙烯涂层,因此用不粘锅烧饭菜时不易粘锅,下列说法正确的是_____
a.聚四氟乙烯分子中没有双键
b.聚四氟乙烯的单体是不饱和烃
c.聚四氟乙烯的化学性质很不活泼
d.聚四氟乙烯的熔沸点很低
乙炔是一种重要的基本有机原料,在一定条件下其衍变关系如图:

已知:B 是一种塑料,75%的 D 溶液在医药上用作消毒剂。试回答下列问题:
(5)比乙炔多一个碳原子的同系物的结构简式是_____。
(6)A 物质的结构简式是_____,A→B 反应类型是_____反应。
(7)出以下各步反应的化学方程式:乙炔→A:_____ 乙炔→C:_____ C→D:_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家开发设计一种天然气脱硫装置,利用如图装置可实现:H2S+O2=H2O2 +S↓。已知甲池中有如下的转化:
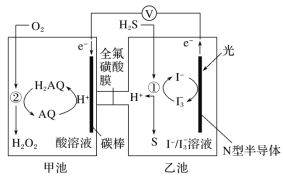
下列说法正确的是( )
A.该装置工作时,只将光能转化为电能
B.该装置工作时,溶液中的H+从甲池经过全氟磺酸膜进入乙池
C.乙池①处发生反应:H2S+I![]() =3I-+S↓+2H+
=3I-+S↓+2H+
D.该装置每处理H2S 2.24L,甲池溶液就增重3.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学内容回答下列问题:
(1)基态硼原子电子排布图为__________________。
(2)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是_____。
A.SO![]() 和NO
和NO![]() B.NO
B.NO![]() 和SO3 C.H3O+和ClO
和SO3 C.H3O+和ClO![]() D.PO
D.PO![]() 和SO
和SO![]()
(3)第三周期某元素的前5个电子的电离能如图1所示。该元素是_____(填元素符号),判断依据是_ ______________。
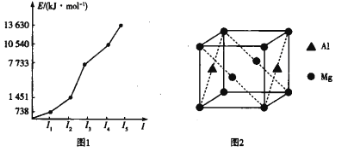
(4)铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有_____________个镁原子最近且等距离。
(5) 配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如下图所示。下列关于Fe(CO)5说法不正确的是________。

A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子的配体与C22-互为等电子体
C.1mol Fe(CO)5含有5mol![]() 键
键
D.Fe(CO)5=Fe+5CO反应中没有新化学键生成
(6)独立的NH3分子中,H—N—H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H—N—H键键角。
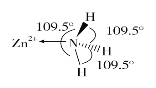
请解释[Zn(NH3)6]2+离子中H—N—H键角变为109.5°的原因是____________________________________________________________。
(7)已知立方BN晶体硬度很大,其原因是________;其晶胞结构如图所示,设晶胞中最近的B、N原子之间的距离为a nm,阿伏加德罗常数的值为NA,则晶体的密度为_____g·cm-3(列式即可,用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以AlCl3、工业V2O5(纯度为96%)为原料,低温提纯制备高纯V2O5,其主要实验流程如下:
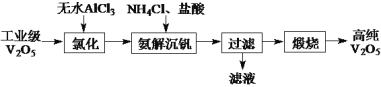
已知:①无水AlCl3升华温度约170℃,在空气中会吸水部分水解。
②VOCl3(三氯氧钒)熔点约78 ℃,沸点约127 ℃,易水解生成V2O5。
③V2O5易溶于碱生成VO![]() (偏钒酸盐),溶于强酸生成
(偏钒酸盐),溶于强酸生成![]() (氧基钒离子)。
(氧基钒离子)。
(1)“氯化”产物为VOCl3和Al2O3,装置如图所示。
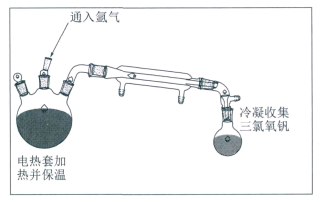
向反应装置中不断通入氩气的目的是_________;反应温度采用160℃左右的原因是_________。
(2)“沉钒”时控制温度为35 ℃、pH约为1,VOCl3转化为(NH4)2V6O16(多钒酸铵),其离子方程式为_________。
(3)“煅烧”时为避免生成的NH3将产物还原,需采取的措施是_________。
(4)氨解沉钒时也可将VOCl3与氨水作用,生成NH4VO3(为避免反应过于剧烈,需先将一定量VOCl3溶解于水中配制成钒溶液)。沉钒率与钒溶液浓度、氨解温度的关系分别如图1、图2所示。
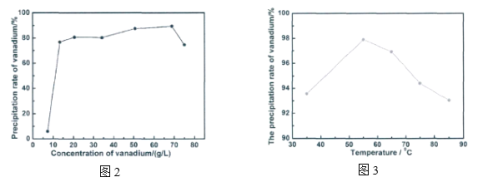
①钒溶液中会存在少量颗粒状沉淀,其可能成分为_________(填化学式)。
②为确定较适宜的沉钒条件,请结合图曲线,补充完整“探究氨水浓度对沉钒率的影响”的实验方案:_________,使用专用仪器测定并计算沉钒率。(实验中可供选择的试剂:50 g·L-1的钒溶液、10 g·L-1的钒溶液、25 %的优级纯氨水、高纯水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原字序数依次增大。A可与其他四种元素分别形成二元化合物,其中只在与D形成的化合物中呈-1价;B2C5对应的水化物与BA3反应生成一种盐X;D的原子半径在短周期中最大(0族元素除外);E元素原子的最外层电子数是其次外层屯子数的3/4倍。请回答下列问题:
(1) X的化学式为_____,化合物DA的电子式为________。
(2)元素的非金属性 C____________ E(填“〉” “<”或“=”)下列各项中,能说明该结论的事实有_______;(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
④单质与氢气化合C比E容易
(3)实验室将BC和BC2组成的混合气体通入下图所示装置中,相来验证浓硝酸的 氧化性比稀硝酸的氧化性强。
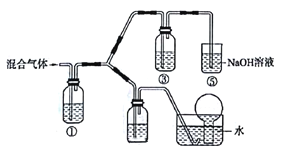
己知:(i)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ii)NaOH溶液勾BC2能完全反应,与BC气体不反应。
a.装置①、②、③中盛放的药品名称依次___________、_______________、______________ 。
b.通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是___________(填一种气体的化学式)。
c.能够说明实验已成功的现象是________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠样品含有少量的Na2SO4 和 Na2CO3,按下列流程进行净化,请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称:______,______,______,______,______,______,______。
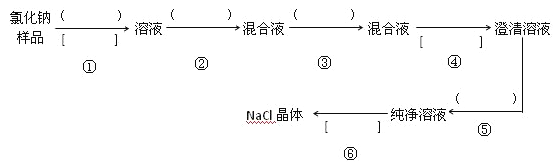
写出有关反应的化学方程式:
第②步:______________________, _________________________。
第③步:______________________。
第⑤步:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷(或氢气、一氧化碳等可燃性气体)和氧气构成燃料电池,则通入甲烷气体的一极是原电池的____极,该极的电极反应式是____,电池工作时的总反应的离子方程式是_____。
(2)熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极气体,空气与CO2的混合气体为正极气体,制得650 ℃下工作的燃料电池,完成下列反应式:
正极:_______,
负极:2CO+2CO32--4e-=4CO2。
总反应:______。
(3)铅蓄电池放电时,总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,由此可以判断:
①原电池的电极材料:负极:__。
②电极反应式:正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,负极反应式为_______。
③工作后,铅蓄电池里电解质溶液的pH____(填“变大”“变小”或“不变”),理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以充分说明反应P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )
A. 反应容器内的压强不随时间改变
B. 反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C. P的生成速率和S的生成速率相等
D. 反应容器内的气体总物质的量不随时间变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com