
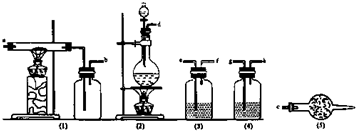
| 仪器标号 | 1 | 2 | 3 | 4 | 5 |
| 试剂标号 | E | AFG | C | G | I |
分析 实验室用浓盐酸和二氧化锰在加热条件下制备氯气,可用食盐晶体和浓硫酸替代盐酸,为得到干燥的氯化铁,生成的氯气需除去氯化氢、水,可分别通过饱和食盐水、浓硫酸,然后在装置1中反应生成氯化铁,为防止污染空气和氯化铁的水解,1还要连接5装置,以吸收氯气和水,以此解答该题.
解答 解:(1)验室制备无水氯化铁,需要先制取氯气,用2装置,根据题意3用于除去氯气中的氯化氢,4用于干燥氯气,由于无水氯化铁遇潮湿空气极易吸水生成FeCl3•nH2O,所以5防止空气中的水蒸气进入,同时吸收未反应的氯气,防止污染空气,则仪器的连接顺序为d→e→f→g→h→a→b→c,
故答案为:d;e;f;g;h;a;b;c;
(2)实验室用浓盐酸和二氧化锰在加热条件下制备氯气,可用食盐晶体和浓硫酸替代盐酸,装置3用于除去氯化氢,可用饱和食盐水,装置4用于干燥氯气,可用浓硫酸,铁和氯气在装置1中进行反应,5加入碱石灰,可吸收氯气,
故答案为:
| 1 | 2 | 4 | 4 | 5 |
| E | AFG | C | G | I |
点评 本题考查制备实验方案设计,为高频考点,题目难度中等,侧重于学生的分析、实验能力的考查,明确原理是解题关键,注意把握相关基本实验方法和操作的把握.


科目:高中化学 来源: 题型:选择题
| A. | 用食醋和淀粉-KI试纸检验碘盐中的KIO3:IO3-+5I-+6H+═3I2+3H2O | |
| B. | 稀HNO3溶液与难溶于水的FeS固体:FeS+2H+═Fe2++H2S↑ | |
| C. | 碳酸氢钙与少量的NaOH溶液反应 Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | Na与水的反应Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 ②
②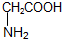 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 有机物①分子中所有原子不可能在同一平面上 | |
| B. | 有机物②与硝基乙烷(CH3CH2NO2)互为同分异构体 | |
| C. | 有机物①与②的核磁共振氢谱具有相同数目的吸收峰 | |
| D. | 有机物①能与浓溴水发生加成反应和取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24L | B. | 4.48L | C. | 5.6L | D. | 11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
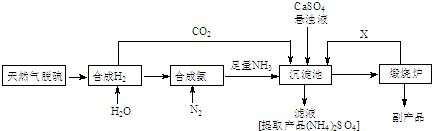

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用渗析的方法精制Fe(OH)3胶体 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com