
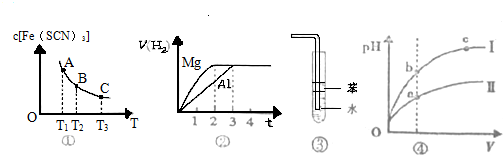
| A、已知图①是体系Fe3++3SCN-?Fe(SCB)3中c[Fe(SCN)3]与温度T的平衡图象,则A点与B点相比,A点的Fe3+浓度大 |
| B、图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V(H2) 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 |
| C、图③可用于吸收HCl气体,并防倒吸 |
| D、图④是某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线,II为醋酸稀释时pH的变化曲线 |
| △V |
| △t |
| △V |
| △t |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,2.24 L CO2中含有的原子数为0.3 NA |
| B、常温下,1 mol Cl2与足量的NaOH溶液反应,转移的电子数为NA |
| C、在同温同压下,3.2 g O2和0.4 g H2具有相同的体积 |
| D、1 mol Na2O2中含有的阴阳离子总数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号元素性质 | ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3+HCl=NH4Cl | ||||
B、CuO+H2
| ||||
C、CaCO3
| ||||
| D、H2SO4+2NaOH=Na2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z、M、Q均为除稀有气体外分布在3个不同短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,X、M在周期表中位置如图所示.
W、X、Y、Z、M、Q均为除稀有气体外分布在3个不同短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,X、M在周期表中位置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 3 |
| O | 2- 4 |
| O | 2- 3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和石灰水中加入生石灰,若保持温度不变,则溶液中Ca2+的物质的量不变 |
| B、升高饱和石灰水的温度时,Ca(OH)2溶度积常数Ksp减小 |
| C、饱和石灰水中加入生石灰,若保持温度不变,则pH不变 |
| D、向饱和石灰水中加入浓CaCl2溶液会有Ca(OH)2沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 葡萄糖注射液 |
| 规格:250mL |
| 密度:1.08g?mL-1 |
| 生产批号:10032032 |
| 有效期:至2013年3月 |
| 质量分数:5% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com