
下列反应原理不符合工业冶炼金属实际情况的是( )
A. 2HgO 2Hg+O2↑ B. 2NaCl(熔融)
2Hg+O2↑ B. 2NaCl(熔融) 2Na+Cl2↑
2Na+Cl2↑
C. 2MgO(熔融)  2Mg+O2↑ D. Fe2O3+3CO
2Mg+O2↑ D. Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
考点: 金属冶炼的一般原理.
专题: 几种重要的金属及其化合物.
分析: 金属的性质不同,活泼性不同,冶炼的方法不同,根据金属活动性强弱,可采用热还原法、电解法、热分解法等冶炼方法.
热分解法:对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来,例如:2HgO 2Hg+O2↑
2Hg+O2↑
热还原法:在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来,例如:
Fe2O3+3CO  2Fe+CO2↑
2Fe+CO2↑
电解法:活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属,例如:2Al2O3 4Al+3O2↑,金属钠、镁采用电解熔融的氯化物的方法,
4Al+3O2↑,金属钠、镁采用电解熔融的氯化物的方法,
利用铝热反应原理还原:V、Cr、Mn、W等高熔点金属可利用铝热反应产生的高温来冶炼.
解答: 解:A、Hg为不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来,故A正确;
B、钠是活泼金属,应采用电解法制取,故B正确;
C、镁是活泼金属,应采用电解法氯化镁的方法制取,氧化镁的熔点太高,消耗再多的资源,故C错误;
D、Fe处于金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来,故D正确.
故选C.
点评: 本题考查金属冶炼的一般方法和原理,注意活泼性不同的金属冶炼的方法不同,本题难度不大.


科目:高中化学 来源: 题型:
下列反应属于取代反应的是( )
|
| A. | C2H4+3O2 | B. | Zn+CuSO4═ZnSO4+Cu |
|
| C. | NaCl+AgNO3═AgCl↓+NaNO3 | D. | CH2Cl2+Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间/s 浓度mol•L﹣1 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)mol•L﹣1 | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/mol•L﹣1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)达到平衡时N2O4的转化率为 %.
(2)20s的四氧化二氮的浓度c1= mol•L﹣1,在0s~20s内四氧化二氮的平均反应速率为 mol•(L•s)﹣1;.
查看答案和解析>>
科目:高中化学 来源: 题型:
在PH=0的无色透明溶液中,下列各组离子一定能大量存在的是( )
A. CH3COO﹣、SO42﹣、K+、Mg2+ B. H+、MnO4﹣、K+、Cl﹣
C. H+、NO3﹣、Na+、SO42﹣ D. OH﹣、NO3﹣、Na+、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是利用丙烯和对二甲苯合成有机高分子材料W的转化关系示意图.
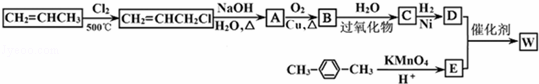
已知:①C不含甲基,B可以发生银镜反应,1molD与足量钠可生成22.4L H2(标准状况下).
①R﹣CH=CH2+H2O R﹣CH2CH2OH
R﹣CH2CH2OH
②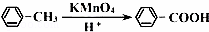
请完成下列各问:
(1)A的结构简式是 ,D的核磁共振氢谱图中有 个峰.
(2)C中所含官能团的名称 、 .
(3)C→D反应类型为 .
(4)有关物质B所具有的性质的叙述中正确的是(填序号) .
a.能发生银镜反应 b.能使溴水褪色 c.能发生酯化反应 d.可发生聚合反应
(5)写出下列反应的化学方程式:
①A→B: .
②D+E→W: .
③D的同分异构体(同一个碳原子上连接两个﹣OH的不能稳定存在)和E的同分异构体反应生成最小环酯: .
(6)物质E有多种同分异构体,请分别写出满足以下条件一个E的同分异构体的结构简式:
ⅰ.①遇FeCl3溶液显紫色 ②可发生银镜反应 ③能发生水解反应 .
ⅱ.①遇FeCl3溶液显紫色 ②可发生银镜反应 ③能和NaHCO3发生反应生成CO2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应的方程式书写正确的是( )
A. 高温下加热硝酸铵固体:NH4NO3 NH3↑+HNO3↑
NH3↑+HNO3↑
B. 将铝片加入烧碱溶液中:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑
C. 向亚硫酸钠溶液中加入足量硝酸:SO32﹣+2H+=SO2↑+H2O
D. 工业制粗硅:C+SiO2 CO2↑+Si
CO2↑+Si
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质与应用均正确的是( )
A. SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力
B. Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒
C. 氨气是一种碱性气体,可用碱石灰或无水CaCl2干燥
D. MgO的熔点很高,可用于制作耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生做乙醛还原性的实验,取1 mol·L-1的CuSO4溶液2 mL和0.4 mol·L-1的NaOH溶液4 mL,在一个试管内混合后加入0.5 mL 40%的乙醛溶液加热至沸腾,无砖红色沉淀,实验失败的原因是( )
A.NaOH不足量 B.CuSO4不足量
C.乙醛溶液太少 D.加热时间不够
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种常见药物①阿司匹林②青霉素③胃舒平④麻黄碱.请回答:
(1)某同学胃酸过多,应选用的药物是 (填序号).
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是 (填序号).
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是 (填序号).
(4)滥用药物会导致不良后果,如过量服用 (填序号)会出现水杨酸中毒,应立即停药,并静脉注射NaHCO3.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com