
| A. | 在船舶的外壳装上镁合金或锌块保护钢铁设备被称为牺牲阳极的阴极保护法 | |
| B. | 赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色 | |
| C. | 海水淡化的方法主要有:蒸馏法、电渗析法、离子交换法等 | |
| D. | 乙烯的产量可以用来衡量一个国家的石油化工发展水平 |
分析 A.锌、铁和海水构成原电池,锌为负极,被消耗,铁为正极,被保护;
B.白色污染、绿色食品与颜色无关;
C.根据海水淡化的主要方法分析;
D.乙烯主要用于制造塑料、合成纤维、有机溶剂等,是石油化工发展的标志.
解答 解:A.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,锌、铁和海水构成原电池,锌作负极,铁作正极被保护,该保护方法为牺牲阳极的阴极保护法,故A正确;
B.白色污染是人们对难降解的塑料垃圾(多指塑料袋)污染环境现象的一种形象称谓.它是指用聚苯乙烯、聚丙烯、聚氯乙烯等高分子化合物制成的各类生活塑料制品使用后被弃置成为固体废物、绿色食品是指安全、无公害、无毒、有利于人体健康的营养食品,二者与颜色无关,故B错误;
C.海水淡化的主要方法有:蒸馏法、电渗析法、离子交换法等,故C正确;
D.乙烯工业的发展,带动了其他以石油为原料的石油化工的发展.因此一个国家乙烯工业的发展水平,已成为衡量这个国家石油化学工业水平的重要标志,故D正确;
故选B.
点评 本题考查较为综合,为高考常见题型,侧重于化学与生活、生产、环境的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:填空题
 利用下列各组中的物质制备并收集少量相应的气体,能采用如图装置的是(2)(3)(9)
利用下列各组中的物质制备并收集少量相应的气体,能采用如图装置的是(2)(3)(9)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于0.6mol | B. | 等于0.15mol | ||
| C. | 介于0.15mol与0.3mol之间 | D. | 等于0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,2NO(g)+O2(g)═2NO2(g)能够自发进行,则该反应的△H<0 | |
| B. | 反应N2(g)+3H2(g)?2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 | |
| C. | 同温、同浓度的硫酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| D. | 硫酸工业中二氧化硫的催化氧化,不采用高压是因为压强对SO2转化率无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气可以用浓硫酸干燥也可用碱石灰干燥 | |
| B. | 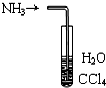 用如图装置吸收NH3可防止倒吸 用如图装置吸收NH3可防止倒吸 | |
| C. | 氨水能导电,所以NH3是电解质 | |
| D. | 氨气可以使湿润的蓝色石蕊试纸变红,依此可检验氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,某温度下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示
工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,某温度下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示查看答案和解析>>
科目:高中化学 来源: 题型:解答题
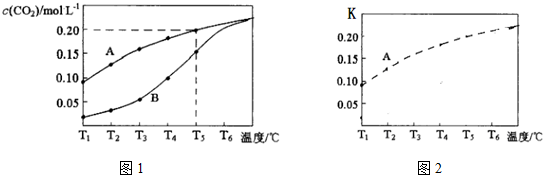
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com