
电化学原理在工业生产中有着重要的作用,请利用所学知识回答有关问题。
(1)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。如是电解产生多硫化物的实验装置:
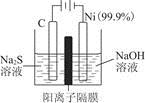
①已知阳极的反应为(x+1)S2-=Sx+S2-+2xe-,则阴极的电极反应式是____________________________
当反应转移x mol电子时,产生的气体体积为____________(标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示):___________________________。
(2)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为______________________。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为_______________________,
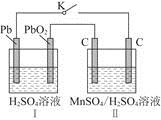
当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为________,MnO2的理论产量为________g。
(3)用图电解装置可制得具有净水作用的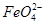 。实验过程中,两极均有气体产生,Y极区溶液逐渐生成
。实验过程中,两极均有气体产生,Y极区溶液逐渐生成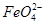
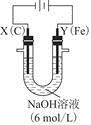
①电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。
②电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=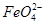 +4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
+4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
(1)①2H2O+2e-=2OH-+H2↑(或2H++2e-=H2↑) 11.2xL
②2S2-+O2+2H2O=2S↓+4OH-
(2)Mn2+-2e-+2H2O=MnO2+4H+
Pb+PbO2+2H2SO4=2PbSO4+2H2O
2 mol 87
(3)增大 4OH--4e-=2H2O+O2↑ 0.28
【解析】
(1)电解时,水电离的H+在阴极发生得电子还原反应,生成H2。根据电子守恒可知有x mol电子转移,产生H2 0.5x mol。S2-具有较强还原性,易被空气中的氧气氧化,故配制溶液时需要氮气作保护气。
(2)根据题意Mn2+失电子生成MnO2,产物中的氧元素来源于水,生成H+,再将电极方程式配平即可。
(3)图中X极的电极反应为2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-),所以X极区的pH增大,由生成氢气672 mL,可知得电子数为0.06 mol,Y极生成氧气为168 mL,失电子数0.03 mol,由得失电子守恒可知铁失电子数为0.03 mol,由电极反应可知铁溶解为0.005 mol,即0.28 g。


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:填空题
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:


(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”、“减小”或“不变”,下同),ΔH的变化是 。请写出NO2和CO反应的热化学方程式: 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为 。
(3)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x= kJ·mol-1(用含a、b、c、d的代表数式表示)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盐类水解的概念与离子浓度大小比较(解析版) 题型:选择题
25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定20.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是

A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10—5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X—)>c(Y—)>c(OH—)>c(H+)
D.HY与HZ混合,达到平衡时: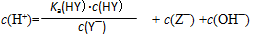
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解规律及电化学计算(解析版) 题型:选择题
电解原理在化学工业中有着广泛的应用。图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。则下列说法不正确的是

A.若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液
B.按图甲装置用惰性电极电解AgNO3溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量
C.按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5 mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol
D.若X、Y为铂电极,a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解池的工作原理、电极反应式的书写(解析版) 题型:选择题
电化学在日常生活中用途广泛,图甲是镁—次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含 的工业废水的处理。下列说法正确的是
的工业废水的处理。下列说法正确的是

A.图乙中 向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去
向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去
B.图乙的电解池中,有0.084 g阳极材料参与反应,阴极会有336 mL的气体产生
C.图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
D.若图甲中3.6 g镁溶液产生的电量用以图乙废水处理,理论可产生10.7 g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解三池的应用(解析版) 题型:选择题
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用右图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是
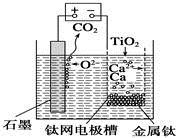
A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子
B.阳极的电极反应式为C+2O2--4e-=CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学甲烷、乙烯及其同系物、苯及其同系物(解析版) 题型:选择题
现有两个热化学反应方程式:
 (l)+H2(g)
(l)+H2(g)
 (l) ΔH>0①
(l) ΔH>0①
 (l)+2H2(g)
(l)+2H2(g)
 (l) ΔH<0②
(l) ΔH<0②
下列说法中不正确的是
A.①②都属于加成反应
B.在通常条件下,①②都能自发进行
C.①吸热、②放热的事实说明苯环中含有的并不是碳碳双键
D.①②中的所有有机物均可使溴水褪色,但褪色原理不完全相同
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的检验(解析版) 题型:选择题
下列有关物质检验的实验结论正确的是
| 实验操作 | 现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有 |
B | 将某气体通入澄清石灰水中 | 变浑浊 | 该气体一定是CO2 |
C | 向某溶液中加入2滴KSCN溶液 | 溶液不显红色 | 溶液中一定含有Fe2+ |
另取样,先滴入氯水,再滴入KSCN溶液 | 溶液变为红色 | ||
D | 将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热 | 有银镜生成 | 该物质一定是葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com