
| A.Q1+ Q2<2Q3 | B.Q1+ Q2>2Q3 |
| C.Q1+ Q2<Q3 | D.Q1+ Q2>Q3 |
科目:高中化学 来源:不详 题型:单选题
| A.上述热化学方程式中的计量数表示分子数 | B.△H 1>△H 2 |
| C.△H 2= -57.3 kJ/mol | D.∣△H 1 ∣>∣△H 2∣ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
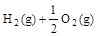 =H2O(g) △H1=a kJ
=H2O(g) △H1=a kJ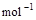 , ②
, ②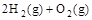 =2H2O(g)△H2=b kJ
=2H2O(g)△H2=b kJ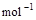 ,
,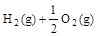 =H2O(l) △H3=c kJ
=H2O(l) △H3=c kJ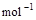 , ④
, ④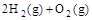 =2H2O(l)
=2H2O(l) 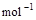 。下列关系式中正确的是( )
。下列关系式中正确的是( )| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1 CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1 CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1| A.加入某物质作催化剂 | B.加入一定量CO |
| C.反应温度降低 | D.增大容器体积 |
 CH3OCH3(g)+CO2(g)的△H= ;830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的△H= ;830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。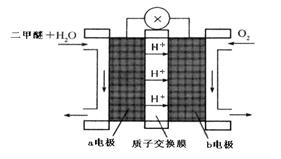
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸与水 | B.生石灰与水 | C.熟石灰与水 | D.氯化钠与水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示。则下列结论正确的是( )
2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示。则下列结论正确的是( )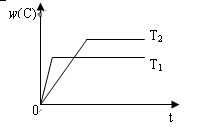
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.AgCl难溶于水,溶液中没有Ag+和Cl- |
| B.自发过程将一定导致体系的熵值增大 |
| C.由能量判据和熵判据组合而成的复合判据,将更适合于所有过程的方向的判断 |
| D.增大反应物的浓度可增大单位体积活化分子百分数,从而使有效碰撞次数增多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com