
| A. | S→SO3→H2SO4 | B. | Fe→FeCl3→FeCl2 | ||
| C. | Si→H2SiO3→Na2SiO3 | D. | Al2O3→Al(OH)3→NaAlO2 |
分析 A.S只能一步转化为二氧化硫;
B.Fe与氯气反应生成氯化铁、氯化铁与Fe反应生成氯化亚铁;
C.Si不能一步转化为硅酸;
D.氧化铝不能一步转化为Al(OH)3.
解答 解:A.S只能一步转化为二氧化硫,至少需要两步生成SO3,故A不选;
B.Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{Fe}{→}$FeCl2,均可一步转化,故B选;
C.Si不能一步转化为硅酸,至少需要两步转化生成硅酸,故C不选;
D.氧化铝不能一步转化为Al(OH)3,至少需要两步转化生成氢氧化铝,故D不选;
故选B.
点评 本题考查物质的性质及相互转化,为高频考点,综合考查元素化合物知识,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
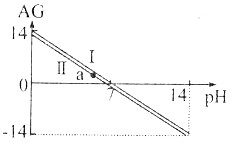
| A. | AG与pH的关系一定是AG=14-2pH | |
| B. | 直线Ⅰ和Ⅱ是因溶液的温度不同引起的,且T(Ⅰ)>T(Ⅱ) | |
| C. | AG=0时,溶液一定呈中性 | |
| D. | a点的溶液中可以有大量Na+、Cl-、Fe3+存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数的大小与温度、浓度、压强、催化剂等有关 | |
| B. | Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)?AgI(s)+Cl-(aq)能够发生 | |
| C. | 当温度升高时,弱酸的电离平衡常数Ka变小 | |
| D. | 化学平衡常数不变时,说明化学反应已达化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- | |
| B. | 鉴别碳酸钠溶液和碳酸氢钠溶液,可以用稀CaCl2 溶液 | |
| C. | 做焰色反应时,每次实验要将铂丝用水洗干净,再蘸取其他物质在灯焰上灼烧 | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应A(s)=B(s);△H<O,则说明A物质比B物质稳定 | |
| B. | Zn(s)+CuSO4 (aq)═ZnSO4 (aq)+Cu(s);△H=-216kJ•mol-1.则反应物总能量<生成物总能量 | |
| C. | 101kPa时,2H2(g)+O2(g)═2H2O(l);△H=-QkJ•mol-1,则H2的燃烧热为$\frac{1}{2}$QkJ•mol-l | |
| D. | H+(aq)+OH- (aq)=H2O(l);△H=-57.3 kJ•mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/K | 平衡浓度mol/L | ||
| CH3OH | CH3OCH3 | H2O | ||
| l | 403 | 0.01 | 0.2 | 0.2 |
| 2 | 453 | 0.02 | 0.3 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
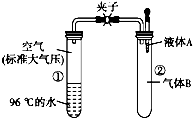 如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 饱和食盐水、氯化氢 | ||
| C. | 氢氧化钠溶液、一氧化碳 | D. | 石灰水、二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com