


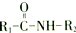 在一定条件下可水解为
在一定条件下可水解为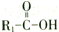 和R2-NH2.H在一定条件下水解的产物之一为氨基酸M,则由M形成二肽的化学方程式为
和R2-NH2.H在一定条件下水解的产物之一为氨基酸M,则由M形成二肽的化学方程式为 ,A在催化剂、空气条件下反应氧化反应生成B,结构B的分子式可知应是甲基被氧化为-COOH,故B为
,A在催化剂、空气条件下反应氧化反应生成B,结构B的分子式可知应是甲基被氧化为-COOH,故B为 ,B与乙二醇发生缩聚反应生成高分子化合物D为
,B与乙二醇发生缩聚反应生成高分子化合物D为 ,由H的结构可知,结合转化关系,可知G为
,由H的结构可知,结合转化关系,可知G为 ,F为
,F为 ,E为
,E为 ,C为
,C为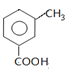 ,据此解答.
,据此解答. ,A在催化剂、空气条件下反应氧化反应生成B,结构B的分子式可知应是甲基被氧化为-COOH,故B为
,A在催化剂、空气条件下反应氧化反应生成B,结构B的分子式可知应是甲基被氧化为-COOH,故B为 ,B与乙二醇发生缩聚反应生成高分子化合物D为
,B与乙二醇发生缩聚反应生成高分子化合物D为 ,由H的结构可知,结合转化关系,可知G为
,由H的结构可知,结合转化关系,可知G为 ,F为
,F为 ,E为
,E为 ,C为
,C为 ,
, ,化学名称为间二甲苯,B为
,化学名称为间二甲苯,B为 ,核磁共振氢谱中有4个峰,故答案为:间二甲苯;4;
,核磁共振氢谱中有4个峰,故答案为:间二甲苯;4; ,E为
,E为 ,官能团的名称为羧基、硝基,故答案为:
,官能团的名称为羧基、硝基,故答案为: ;羧基、硝基;
;羧基、硝基; )的同分异构体满足下列条件:①苯环上只有-个链状取代基 ②能发生酯化反应 ③碳碳双键的碳原子上不连-OH,符合条件的同分异构体有:
)的同分异构体满足下列条件:①苯环上只有-个链状取代基 ②能发生酯化反应 ③碳碳双键的碳原子上不连-OH,符合条件的同分异构体有: ,故答案为:
,故答案为: ;
;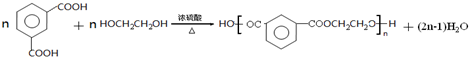 ,
,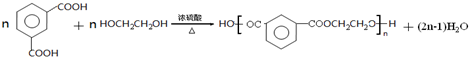 ;
;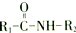 在一定条件下可水解为
在一定条件下可水解为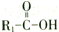 和R2-NH2.H在一定条件下水解的产物之一为氨基酸M为
和R2-NH2.H在一定条件下水解的产物之一为氨基酸M为 ,则由M形成二肽的化学方程式为:
,则由M形成二肽的化学方程式为: ,
, .
.


科目:高中化学 来源: 题型:
| A、在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数 |
| B、温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| C、AgCl的Ksp=1.8×10-10 mol2?L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2?L-2 |
| D、向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl |
| B、NaOH固体 |
| C、MgCl2固体 |
| D、NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸和氯水用棕色试剂瓶保存 |
| B、硫化钠和亚硫酸钠固体长期暴露在空气中变质 |
| C、常温下铁和铂都不溶于浓硝酸 |
| D、SO2和Na2SO3溶液都能使氯水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
| B、Ksp?Kw=Kh | ||
| C、Ksp?Kh=(Kw)3 | ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com