
分析 (1)根据方程式M(OH)2+Na2CO3=MCO3↓+2NaOH、NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O来计算;
(2)根据方程式MCO3$\frac{\underline{\;高温\;}}{\;}$MO+CO2↑来计算;
(3)根据所求结果结合题意:金属M的氢氧化物的水合晶体M(OH)2•xH2O与Na2CO3的混合物共36.800g来计算;
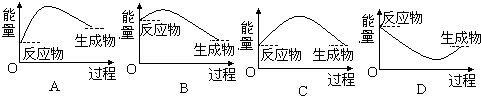
(4)氢氧化物与NH4Cl混合发生反应是吸热反应,玻璃片与烧杯粘在一起,当反应物的能量低于生成物总能量时,反应是吸热反应.
解答 解:(1)设混合物含M(OH)2•xH2O的物质的量为amol,含Na2CO3b mol,滤液与酸作用不产生气体,所以滤液中不含CO32-,即Na2CO3完全反应.
M(OH)2+Na2CO3=MCO3↓+2NaOH
1 1 1
b b b
n(OH-)=2amol,根据NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O,则n(OH-)=n(NH3)=$\frac{4.48L}{22.4L/mol}$=0.2 mol即2a=0.2mol,a=0.1mol,所以n(OH-)=0.2mol,
故答案为:0.2;
(2)设M的相对原子质量为m,则:MCO3$\frac{\underline{\;高温\;}}{\;}$MO+CO2↑
m+60 m+16
9.850 7.650
所以$\frac{m+60}{9.850}=\frac{m+16}{7.650}$,解得:m=137,故答案为:137;
(3)M是Ba,m(MCO3)=(137+60)×b=9.850,即b=0.05 mol,m(M(OH)2•xH2O)+m(Na2CO3)=36.800,
即(137+34+18x)×0.1+106×0.05=36.800,解得x=8,所以M氢氧化物的水合晶体的化学式为Ba(OH)2•8H2O,
故答案为:Ba(OH)2•8H2O;
(4)氢氧化物与NH4Cl混合发生反应是吸热反应,玻璃片与烧杯粘在一起,说明该反应为吸热反应,当反应物的能量低于生成物总能量时,反应是吸热反应,只有A反应物的能量低于生成物总能量.故答案为:随烧杯一起被拿起来;A.
点评 本题考查学生根据化学方程式来确定物质以及量的多少的计算能力,注意平时知识的积累,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
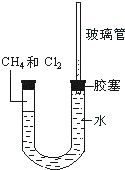 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:1)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:1)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
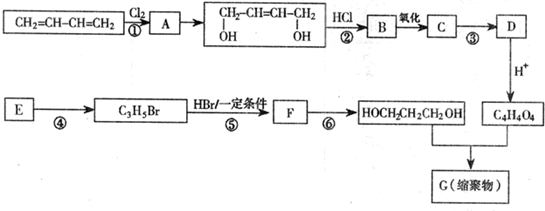
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、SO42-、K+、Cl- | B. | CH3COO-、Na+、Cl-、NH4+ | ||
| C. | CH3COO-、Na+、OH-、K+ | D. | K+、SO42-、Na+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com