

分析 (1)镁在二氧化碳气体中燃烧生成黑色固体为碳和白色固体为氧化镁;
(2)Mg与NO2的反应类比Mg与CO2反应的思路写出,镁在二氧化氮气体中反应生成氧化镁和氮气;
(3)①依据猜想镁条在二氧化氮气体中燃烧生成氮气和氧化镁,装置中A的主要作用是吸收过量二氧化氮,依据反应2NO2+2NaOH=NaNO3+NaNO2+H2O分析应选择氢氧化钠溶液;
②使装置中充满二氧化氮气体,干燥管吸收过量的二氧化氮,防止污染空气;B装置是排水量气法收集氮气;
③应先在装置中充满二氧化氮气体再进行加热,按照此操作顺序进行连接.
解答 解:(1)点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体为氧化镁和碳,反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(2)类比Mg与CO2反应的思路,镁在二氧化氮气体中反应生成氧化镁和氮气,反应的化学方程式为:4Mg+2NO2$\frac{\underline{\;点燃\;}}{\;}$4MgO+N2,
故答案为:4Mg+2NO2$\frac{\underline{\;点燃\;}}{\;}$4MgO+N2;
(3)①依据反应2NO2+2NaOH=NaNO3+NaNO2+H2O分析,装置A主要吸收多余的二氧化氮气体,需要用氢氧化钠溶液,
故答案为:NaOH溶液;
②干燥管是在充满二氧化氮气体过程中避免污染气体排放到空气中污染空气,B装置是排水量气方法收集反应生成的氮气,
故答案为:吸收NO2避免环境污染;收集N2;
③应先在装置中充满二氧化氮气体再进行加热,防止空气的影响,所以实验顺序为badc,
故答案为:badc.
点评 本题考查物质性质实验的设计和实验验证方法和反应现象的分析判断,掌握氮氧化物的性质以及依据现象判断产物是解题关键,题目难度中等.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
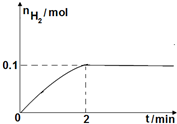 硫一碘循环分解水制氢主要涉及下列反应:
硫一碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过NaOH溶液后再通过浓硫酸 | B. | 通过CuSO4溶液后再通过石灰水 | ||
| C. | 通过P2O5后再通过固体NaOH | D. | 通过碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
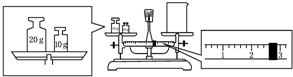 实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液245mL:
实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液245mL:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
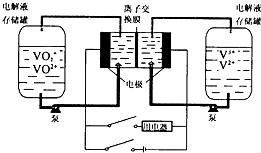
| A. | 充电时阴极的电极反应是V3++e-=V2+ | |
| B. | 放电时,VO2+作氧化剂,在正极被还原,V2+做还原剂,在负极被被氧化 | |
| C. | 若离子交换膜为质子交换膜,充电时当有1mol e-发生转移时,左槽电解液的H+的物质的量增加了1mol | |
| D. | 若离子交换膜为阴离子交换膜,放电时阴离子由左罐移向右罐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
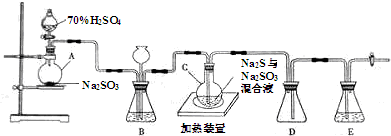
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.00 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +4 | C. | 0 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com