
分析 (1)化合价升高值=化合价降低值=转移电子数,根据化合价的变化来确定电子转移数目;
(2)A、NO2(g)+SO2(g)=SO3(g)+NO(g)△H=-41.8kJ•mol-1;B、2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ•mol-1,则反应:2NO(g)+O2(g)=2NO2(g)可以看成是B-2A得到的,根据盖斯定律结合热化学方程式的书写来回答;
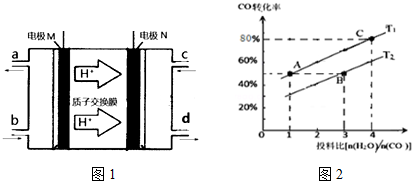
(3)由氢离子的移动方向可知,M区为负极,发生失电子的氧化反应;
(4)①A.逆反应速率先增大后减小,可能是增大生成物浓度;
B.H2的转化率增大,平衡一定正向移动;
C.反应物的体积百分含量减小,可能是增大生成物浓度等;
D.容器中的二氧化碳和氢气浓度比值变小,可能是减小二氧化碳的物质的量.
②根据平衡常数仅与温度有关,温度不变,平衡常数不变,T1温度下,根据平均反应速率v(CO)=$\frac{△c}{△t}$来计算,根据Qc和K的关系判断反应的方向.
解答 解:(1)NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5mol O2(标准状况)时,转移电子的物质的量是1mol,故答案为:1;
(2)已知:A、NO2(g)+SO2(g)=SO3(g)+NO(g)△H=-41.8kJ•mol-1;
B、2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ•mol-1,则反应:2NO(g)+O2(g)=2NO2(g)可以看成是B-2A得到的,所以该反应的△H=-196.6kJ•mol-1-2(-41.8kJ•mol-1)=-113.0 kJ•mol-1,故答案为:2NO(g)+O2(g)=2NO2(g)△H=-113.0 kJ•mol-1;
(3)由氢离子的移动方向可知,M区为负极,发生的电极反应式为N2H4-4e-=N2↑+4H+,故答案为:N2H4-4e-=N2↑+4H+;
(4)①A.逆反应速率先增大后减小,可能是增大生成物浓度,平衡逆向移动,故A错误;
B.H2O(g)的体积百分含量减小,可能是增大生成物浓度,平衡不一定正向移动,故B错误;
C.CO的转化率增大,平衡正向移动,故C正确;
D.容器中的二氧化碳和氢气浓度比值变小,可能是减小二氧化碳的物质的量,平衡逆向移动,故D错误,
故选:C;
②平衡常数仅与温度有关,温度不变,平衡常数不变,所以KA=KC,反应是吸热反应,所以升高温度,平衡正向移动,CO的转化率增加,T2<T1,温度越高,K越大,所以KA=KC>KB,T1温度下,将1molCO和4mol H2O (g)充入2L的密闭容器中,5min后反应达到平衡状态,此时CO的转化率是80%,则0~5min内的平均反应速率v(CO)=$\frac{\frac{1mol}{2L}×80%}{5min}$=0.08mol•L-1•min-1,CO的平衡浓度是0.1mol/L,H2O(g)的平衡浓度是1.6mol/L,H2、CO2 的平衡浓度是0.4mol/L,
此时K=$\frac{0.4×0.4}{0.1×1.6}$=1,若保持其他条件不变,向平衡体系中再通入1molCO和1molCO2,此时Qc=$\frac{0.4×0.9}{0.6×1.6}$<1,即Qc<K,所以v(正)>v(逆),
故答案为:0.08mol•L-1•min-1;>.
点评 本题考查化学平衡计算与影响因素、盖斯定律的应用、对图象分析提取信息能力等,较好的考查学生对知识的迁移应用.


科目:高中化学 来源: 题型:选择题
| A. | 变性蛋白质不能食用 | |
| B. | 可用甲醛浸泡海鲜 | |
| C. | SO2可以用来增白食品 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
| A. | Z、Q均为ⅣA族元素 | |
| B. | X、Y、M三种元素中金属性最强的是M | |
| C. | R、Z形成的R2Z分子是非极性分子 | |
| D. | M的氢氧化物和Y的氢氧化物都能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
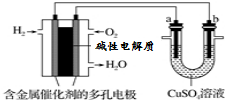
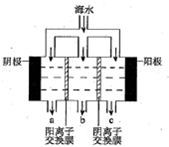
| A. | 此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 | |
| B. | 若a为纯铜,b为粗铜,该装置可用于粗铜的电解精炼 | |
| C. | 燃料电池中正极反应为O2+4e-+2H2O=4OH- | |
| D. | 电子经导线流入b电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X与Y组成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | W、R两种元素对应的简单离子都能影响水的电离平衡 | |
| C. | 由X、Y、Z三种元素组成的化合物,其水溶液显碱性 | |
| D. | 工业上用电解熔融的Z和X组成的化合物来制取Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
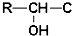 ≡C-R′
≡C-R′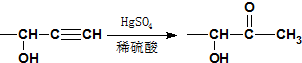
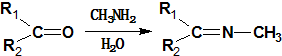
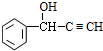 .
. +CH3NH2$\stackrel{水}{→}$
+CH3NH2$\stackrel{水}{→}$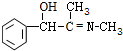 +H2O.
+H2O.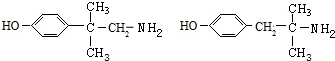 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 葡萄糖和蛋白质等高分子化合物是人体必需的营养物质 | |
| B. | 自来水厂用明矾净水,也可以用ClO2代替 | |
| C. | 居室中放置一盆石灰水可以吸收CO,预防中毒 | |
| D. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
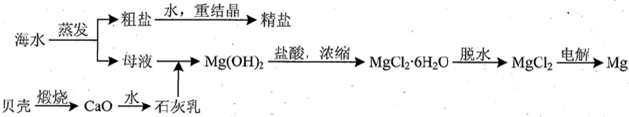
 海水中主要离子的含量如下:
海水中主要离子的含量如下:| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com