
【题目】![]() 是一种有机烯醚,可以用烃A通过下列路线制得:
是一种有机烯醚,可以用烃A通过下列路线制得:
![]()
则下列说法不正确的是( )
A.![]() 的分子式为C4H6O
的分子式为C4H6O
B.A的结构简式是CH2=CHCH=CH2
C.B存在顺反异构现象
D.②、③的反应类型分别为水解反应、消去反应
【答案】D
【解析】
由合成流程可知,A与溴发生加成反应得B,B在碱性条件下水解得C,C在浓硫酸作用下发生脱水成醚,结合![]() 的结构可逆推得到C为HOCH2CH=CHCH2OH,B为BrCH2CH=CHCH2Br,A为CH2=CHCH=CH2,以此来解答。
的结构可逆推得到C为HOCH2CH=CHCH2OH,B为BrCH2CH=CHCH2Br,A为CH2=CHCH=CH2,以此来解答。
A.![]() 的结构中的节点为碳原子,每个碳原子形成四个共价键,不足键用氢原子补齐,则分子式为C4H6O,故A正确;
的结构中的节点为碳原子,每个碳原子形成四个共价键,不足键用氢原子补齐,则分子式为C4H6O,故A正确;
B.根据分析,A的结构简式是CH2=CHCH=CH2,故B正确;
C.B为BrCH2CH=CHCH2Br,双键两端的碳原子上存在顺反异构现象,故C正确;
D.由上述分析可知,①、②、③的反应类型分别为加成反应、水解反应、取代反应,故D错误;
答案选D。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
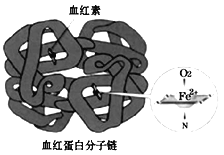
【题目】铁是人体必需的微量元素,在肺部,血红蛋白中血红素的Fe2+与O2结合,把O2送到各个组织器官。铁摄入不足可能引起缺铁性贫血。黑木耳中含有比较丰富的铁元素,某研学小组测定其含量。
(1)(铁元素的分离) 称量黑木耳,将之洗净切碎,用蒸馏水浸泡,但浸泡液中未能检测到铁元素。在坩埚中高温灼烧黑木耳,使之完全灰化。用酸充分浸泡溶解,过滤,滤液备用。
① 浸泡液检测不出铁元素的原因是____。
② 滤液中铁元素的存在形式是Fe2+、____。
(2)(配制溶液) 将滤液配制成100 mL 溶液。实验时需要选择合适的仪器完成(铁元素的分离)、(配制溶液)2个实验,下列仪器不必使用的是____。
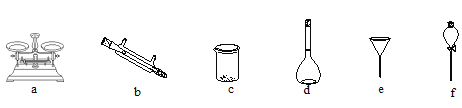
(3)(铁元素含量测定) 研学小组提出如下测量方案:
Ⅰ. 沉淀法:向溶液中加入足量NaOH溶液,搅拌使Fe(OH)2全部转化为Fe(OH)3然后过滤、洗涤沉淀、加热烘干、称量Fe(OH)3的质量进行分析。请指出该测量方案是否可行及其理由____。
Ⅱ. 比色法:流程示意如下:
![]()
① 用离子方程式解释加入H2O2的目的是____。
② 溶液a的颜色是____。
③ 溶液颜色越深,光的透过能力越差,即透光率越小。若不加H2O2,测出黑木耳中铁元素的含量____(填“偏大”或“偏小”)。
(4)亚铁盐易被氧化,但在体内Fe2+参与O2的运输却不被氧化。蛋白质是一种既有亲水部分、又有疏水部分的大分子,为血红素提供了疏水环境。可见,氧化还原反应能否发生与___有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中通过以下反应制得:3SiO2+6C+2N2![]() Si3N4+6CO,下列说法正确的是
Si3N4+6CO,下列说法正确的是
A. 在氮化硅的合成反应中,氮气是还原剂,二氧化硅是氧化剂
B. 上述反应中每生成1 mol氮化硅,氮气得到12 mol电子
C. 该反应属于四个基本反应类型之一
D. 该反应无有毒气体产生,不需要尾气处理装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随走始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随走始n(A)∶n(B)的变化关系。则下列结论正确的是
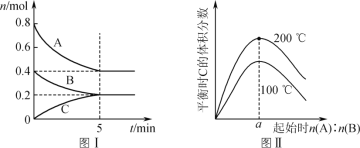
A.200 ℃时,反应达平衡时的平均速率v(B)=0.002 mol·(L·min)-1
B.图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:
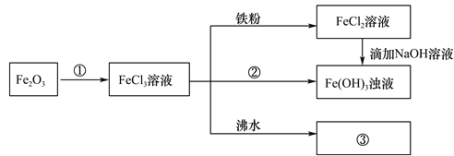
(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________ ,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③为__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿“烧渣”(主要成分:Fe3O4、Fe2O3和FeO)制备绿矾(FeSO4·7H2O))的流程如图:
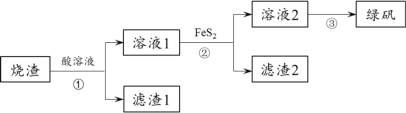
已知:①FeS2(S的化合价为-1)难溶于水。②FeS2+7Fe2(SO4)3+8H2O =15FeSO4+8H2SO4
(1)①中加入的酸为________,滤渣2的主要成分是 __________。
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、___________。
(3)检验②中Fe3+已经完全转化成Fe2+的实验方法:取适量溶液2,________。
(4)通过③得到绿矾晶体的实验操作:____________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧、硫、硒(Se)、碲(Te)、钋(Po)是元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1)硒在元素周期表中的位置________。
(2)![]() Po的中子数为________。
Po的中子数为________。
(3)某温度时,该族单质与H2反应生成气态H2X的热化学方程式如下:
O2(g)+2H2(g)=2H2O(g) △H1=-484 kJ/mol
S(g)+H2(g)![]() H2S(g) △H2=-20 kJ/mol
H2S(g) △H2=-20 kJ/mol
Se(g)+H2(g)![]() H2Se(g) △H3=+81kJ/mol
H2Se(g) △H3=+81kJ/mol
①硫和硒氢化物的热稳定性:H2S________ H2Se(填“>”、“=”或“<”);判断依据是________。
②写出O2(g)与H2S(g)反应生成H2O(g)和S(g)的热化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( )
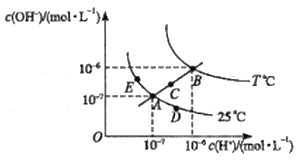
A.图中五点Kw间的关系B>C>A=D=E
B.若从A点到C点,可采用温度不变在水中加入适量的NH4Cl固体
C.若从A点到D点,可采用温度不变在水中加入少量的酸
D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com