
【题目】下列物质中,属于共价化合物的是( )
A.CO2B.NH4ClC.CaCl2D.NaCl
 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】
一元取代苯进行苯环上的取代反应时,原有的基团对后进入基团在苯环上的位置有定位效应。如若原有基团为-CH3、-OH、-X(卤素原子)时新进入基团在其邻、对位; 若原有基团为-NO2、-CHO、-COOH时新进入基团在其间位。
2-氨基-3-氯苯甲酸(F)是重要的医药中间体,其制备流程图如下:

已知: (弱碱性,易被氧化)
(弱碱性,易被氧化)
回答下列问题:
(1)反应①的类型是_____________,反应⑧所需的试剂和条件是_____________________。
(2)F中的非含氧官能团的名称是______________________。
(3)C的结构简式是_______________;B的所有同分异构体中满足下列条件的有_______种:
①能与NaOH溶液反应
②含有苯环且苯环上连有氨基(-NH2)
(4)写出⑥的化学反应方程式:_____________________________________________,该步反应的主要目的是______________________________。
(5)参照上述合成路线及信息,写出以苯为原料合成邻硝基苯酚(  )的合成路线(注明反应试剂和条件,无机试剂任选) ______________。
)的合成路线(注明反应试剂和条件,无机试剂任选) ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是

A. 若隔膜为阴离子交换膜,则OH-自右向左移动
B. 铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+8H+
C. 电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
D. 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛与铁是很重要的金属。已成为化工生产中重要的材料。回答下列问题:
(1)基态钛原子的价电子排布式为__________________,金属钛晶胞如下左图所示,晶胞参数为a=b= 295.08pm,c=468.55pm,α=β=90%,y= 120%。金属钛为______________堆积(填堆积方式)。
(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为____________晶 体。
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
离子晶体 | KCl | CaO |
晶格能(kJ/mol) | 715 | 3401 |
解释KCl晶格能小于CaO的原因:_______________。
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是________。
(4)钙钛矿晶体的结构如下右图所示。晶体的化学式为_________________。
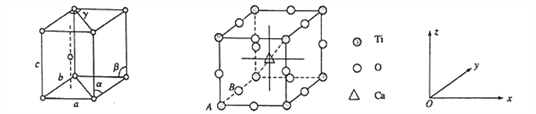
晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca 离子的原子坐标为______________。
(5)Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:

①δ、α两种晶体晶胞中铁原子的配位数之比为_______________________。
②若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为________g/cm3(列出算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置放置一段时间后,铁钉均被腐蚀。下列有关描述不正确的是( )
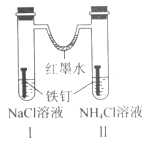
A.红墨水水柱两边的液面变为左低右高
B.I 和Ⅱ中负极反应式均为 Fe-2e-=Fe2+
C.I 中正极反应式为 O2+2H2O+4e-=4OH
D.Ⅱ中 NH4Cl 溶液里有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体可能是( )
①Cl2②NO2③H2S④SO2⑤溴蒸气⑥HCl中的
A.①④⑤
B.①②⑤
C.①②⑥
D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①298 K时K(HF)=3.5×10-4,Ksp(CaF2)=1.8×10-7
②HF(aq)![]() H+(aq)+F-(aq) ΔH<0
H+(aq)+F-(aq) ΔH<0
根据以上已知信息判断下列说法正确的是( )
A. 298 K时,加蒸馏水稀释HF溶液,![]() 保持不变
保持不变
B. 308 K时,HF的电离常数Ka>3.5×10-4
C. 298 K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小
D. 2HF(aq)+Ca2+(aq)![]() CaF2(s)+2H+(aq) K≈0.68
CaF2(s)+2H+(aq) K≈0.68
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g) ΔH = +180 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH =-483 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH=-93 kJ·mol-1
则氨的催化氧化反应的热化学方程式为___________________________________。
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如下图所示。
N2(g)+2CO2(g) ΔH<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如下图所示。

①NO的平衡转化率为_________,0~20min平均反应速率v(NO) =__________,25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将_________移动(填“向左”、“向右”或“不”)。
②下列可说明该反应已经达到平衡的是_______。
a. v生成(CO2)= v消耗(CO)
b.单位时间内消耗2n mol CO2的同时生成n mol N≡N
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不再改变
e.NO、CO、N2、CO2的浓度相等
(3)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料。已知肼空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼空气燃料电池放电时,负极的反应式是__________________________。
(4)假设使用肼空气燃料电池作为本过程中的电源,铜片的质量变化128 g,则肼空气燃料电池理论上消耗标准状况下的空气______L(假设空气中氧气体积分数为20%)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物污染日益严重,请分析下列有关NO、NO2等的试题,然后填空。
(1)如图1所示为N2(g)和O2(g)生成NO(g)过程中的能量变化。

由图1写出N2(g)和O2(g)生成NO(g)的热化学反应方程式:_______________________。
(2)图2所示是1 mol NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com