
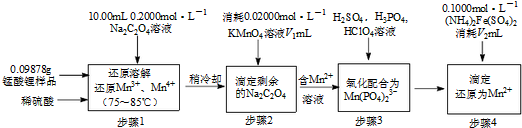
分析 (1)LiaMnbOc中锂显+1价,氧显-2价,设Mn的化合价为+x,根据化合价代数和为零求锰的化合价
(2)用高锰酸钾溶液滴定剩余的草酸钠,当滴定完全后,显示高锰酸钾的颜色,当滴入最后一定高锰酸钾溶液,溶液由无色变为浅红色,且30s内不褪色;高锰酸钾在酸性条件下,发生自身氧化还原反应,生成二氧化锰及氧气;
(3)n(Na2C2O4)=0.2000mol/L×0.01L=2.000×10-3mol,
n(KMnO4)=0.02000mol/L×0.022L=4.400×10-4mol,
还原Mn4+、Mn3+的草酸钠为2.000×10-3mol-$\frac{5}{2}$×4.400×10-4mol=9.000×10-4mol,
n(Mn4+)+$\frac{1}{2}$n(Mn3+)=9.000×10-4mol ①
锰酸锂(LiaMnbOc)中总锰量为n(Mn4+)+n(Mn3+)+n(Mn2+)=n[(NH4)2Fe(SO4)2]-n(KMnO4)=0.1000mol/L×0.0164L-4.400×10-4mol=1.2000×10-3mol②,最后锰根据锰的总化合价除以锰的总物质的量为平均价态.
解答 解:(1)LiaMnbOc中锂显+1价,氧显-2价,设Mn的化合价为+x,根据化合价代数和为零,a+bx-2c=0,x=+$\frac{2c-a}{b}$;
故答案为:+$\frac{2c-a}{b}$;
(2)用高锰酸钾溶液滴定剩余的草酸钠,当滴定完全后,显示高锰酸钾的颜色,当滴入最后一定高锰酸钾溶液,溶液由无色变为浅红色,且30s内不褪色;高锰酸钾在酸性条件下,发生自身氧化还原反应,生成二氧化锰及氧气,离子方程式为4MnO4-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$4MnO2+2H2O+3O2↑;
故答案为:当滴入最后一定高锰酸钾溶液,溶液由无色变为浅红色,且30s内不褪色;4MnO4-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$4MnO2+2H2O+3O2↑;
(3)n(Na2C2O4)=0.2000mol/L×0.01L=2.000×10-3mol,
n(KMnO4)=0.02000mol/L×0.022L=4.400×10-4mol,
还原Mn4+、Mn3+的草酸钠为2.000×10-3mol-$\frac{5}{2}$×4.400×10-4mol=9.000×10-4mol,
n(Mn4+)+$\frac{1}{2}$n(Mn3+)=9.000×10-4mol ①
锰酸锂(LiaMnbOc)中总锰量为n(Mn4+)+n(Mn3+)+n(Mn2+)=n[(NH4)2Fe(SO4)2]-n(KMnO4)=0.1000mol/L×0.0164L-4.400×10-4mol=1.2000×10-3mol ②,
锰酸锂样品中锰的平均价态为$\frac{4n(M{n}^{4+})+3n(M{n}^{3+})+2n(M{n}^{2+})}{n(M{n}^{4+})+n(M{n}^{3+})+n(M{n}^{2+})}$=$\frac{2(①+②)}{②}$=$\frac{4.2000×1{0}^{-3}mol}{1.2000×1{0}^{-3}mol}$=+3.50,
答:该锰酸锂试样中锰的平均价态为+3.50.
点评 本题考查氧化还原反应的计算,为高频考点,明确发生的反应及各个物理量之间的关系是解本题关键,侧重考查学生分析计算能力,题目难度中等.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子组成相差1个或若干个CH2原子团的物质互称为同系物 | |
| B. | 相对分子质量相同的有机物互为同分异构体 | |
| C. | 碳原子之间只以单键相结合的链烃为烷烃 | |
| D. | 含碳化合物一定为有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中:2c (H+)=c(A-)+c(OH-) | |
| B. | 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1 HA溶液与0.05 mol•L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)═c(A-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 6.3g | C. | 5.6g | D. | 11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
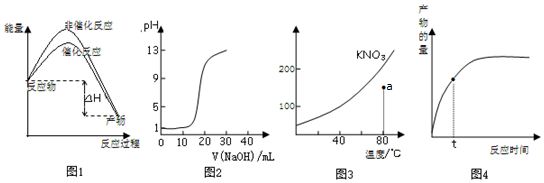
| A. | 图1表示加入催化剂不影响反应的焓变 | |
| B. | 图2表示用0.10mol/L CH3COOH溶液滴定20.00 mL0.10mol/LNaOH溶液所得到的滴定曲线 | |
| C. | 图3表示KNO3的溶解度曲线,图中点所示的溶液是80℃时KNO3的不饱和溶液 | |
| D. | 图4表示t时正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 | |
| B. | AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3•H2O反应也生成AlO2- | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应也生成FeI3 | |
| D. | Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应也生成Na2SO3和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 可以用澄清石灰水,鉴别Na2CO3溶液和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ca2+ | |
| B. | 用玻璃棒蘸取新制氯水,点在pH试纸的中央,与标准比色卡比较,测定氯水的pH | |
| C. | 某溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com