
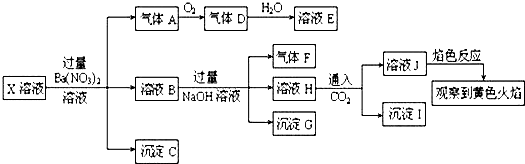
| A. | X中不能确定的离子是Fe3+、A13+、K+、Na+和C1- | |
| B. | 沉淀G中加入盐酸溶解,滴加KSCN溶液显红色,可以确定原溶液中有Fe3+ | |
| C. | 溶液J焰色反应显黄色,则说明原溶液中存在Na+ | |
| D. | 沉淀I一定是A1(OH)3 |
分析 ①强酸性溶液中CO32-、SO32-不能存在;
②X溶液中加入过量Ba(NO3)2溶液生成沉淀C是BaSO4,说明有SO42-存在;硝酸被还原生成气体A为NO,说明有还原剂Fe2+存在,(即3Fe2++4H++NO3-=3Fe3++NO↑+2H2O).
③溶液B加入过量NaOH溶液,生成的沉淀G为Fe(OH)3;生成的气体F为NH3,说明有NH4+存在.
④溶液H通入CO2生成沉淀I,由于前面加入过量的Ba(NO3)2溶液,引入了大量Ba2+,所以沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在A13+,所以这里也不能确定沉淀I中有A1(OH)3;溶液J的焰色反应呈黄色,说明溶液J中有Na+,但由于前面加入过量NaOH溶液,引入了较多的Na+,因此不能确定溶液X中是否存在Na+;因为焰色黄色能掩盖紫色焰色,所以不能确定溶液X中是否有K+;另外,上述实验过程还不能确定溶液X中是否存在C1-.
解答 解:①强酸性溶液中CO32-、SO32-不能存在;②X溶液中加入过量Ba(NO3)2溶液生成沉淀C是BaSO4,说明有SO42-存在;硝酸被还原生成气体A为NO,说明有还原剂Fe2+存在,(即3Fe2++4H++NO3-=3Fe3++NO↑+2H2O),在此反应中,Fe2+被氧化为Fe3+.③溶液B加入过量NaOH溶液,生成的沉淀G为Fe(OH)3;生成的气体F为NH3,说明有NH4+存在.④溶液H通入CO2生成沉淀I,由于前面加入过量的Ba(NO3)2溶液,引入了大量Ba2+,且前面加入的NaOH是过量的,所以沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在A13+,所以这里也不能确定沉淀I中有A1(OH)3;溶液J的焰色反应呈黄色,说明溶液J中有Na+,但由于前面加入过量NaOH溶液,引入了较多的Na+,因此不能确定溶液X中是否存在Na+;因为焰色黄色能掩盖紫色焰色,所以不能确定溶液X中是否有K+;另外,上述实验过程还不能确定溶液X中是否存在C1-;
A.X中肯定存在Fe2+、NH4+、SO42-,A13+、Fe3+、Na+、K+和C1-不能确定,故A正确;
B.沉淀G为Fe(OH)3,但Fe3+可能是原来有的,也可能是Fe2+被氧化生成的,故B错误;
C.通过以上分析知,不能确定原来溶液中是否含有钠离子,故C错误;
D.沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在A13+,所以这里也不能确定沉淀I中有A1(OH)3,故D错误;
故答案为:A.
点评 本题考查离子组推断题,题目具有一定难度,本题解答时一定要紧扣反应现象,推断各离子存在的可能性,本题易错点为(D)题,注意溶液中隐含的酸性条件下发生的氧化还原反应.


科目:高中化学 来源: 题型:选择题
| A. | 2NO2(g)?N2O4(g),升温时体系颜色加深说明正反应为吸热反应 | |
| B. | N2(g)+3H2(g)?2NH3(g),若升温时NH3的浓度减小,则平衡常数K增大 | |
| C. | CO(g)+H2O(g)?CO2(g)+H2(g),升温时CO的转化率增大,说明正反应为吸热反应 | |
| D. | 反应2HI(g)?H2(g)+I2(g)达到平衡后,增大HI的物质的量,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
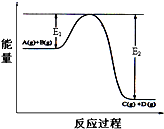 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钴的一种核素 | B. | 质子数为27 | C. | 核外电子数为27 | D. | 中子数为60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com