
| A. | SO2能使溴水褪色,这表现了SO2的漂白性 | |
| B. | 钠钾合金可用于快中子反应堆的热交换剂 | |
| C. | 氨的水溶液能导电,所以氨是强电解质 | |
| D. | 按a、b两种途径制备等量的硝酸镁,消耗的二种酸的物质的量不同 途径a:Mg$→_{△}^{O_{2}}$MgO$\stackrel{稀硝酸}{→}$Mg(NO3)2 途径b:Mg$\stackrel{浓硫酸}{→}$MgSO4$\stackrel{Ba(NO_{3})_{2}溶液}{→}$Mg(NO3)2 |
分析 A.二氧化硫具有还原性,溴单质具有氧化性,二者发生氧化还原反应;
B.钠钾合金导热性强;
C.电解质必须本身能够电离;
D.按a、b两种途径制备等量的硝酸镁,设硝酸镁为1mol,结合元素守恒和化学方程式定量关系计算分析判断.
解答 解:A.SO2能使溴水褪色,是因为发生氧化还原反应,体现其还原性,故A错误;
B.钠钾合金导热性强,可用于快中子反应堆的热交换剂,故B正确;
C.氨气本身不能电离,属于非电解质,故C错误;
D.途径a生成1mol硝酸镁需要硝酸2mol,途径b生成1mol硝酸镁需要浓硫酸2mol,Mg+2H2SO4=MgSO4+SO2↑+2H2O,二者消耗的酸相同,故D错误;
故选B.
点评 本题考查了物质的性质、用途、制备,性质决定用途,明确物质性质是解题关键,侧重考查学生对基础知识掌握熟练程度,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 所得液体属于纯净物 | B. | 该红褐色液体能产生了达尔效应 | ||
| C. | 所得液体中分散质粒子只有Fe(OH)3 | D. | 上述实验过程中没有发生化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融烧碱时不能使用石英坩埚:SiO2+2NaOH$\stackrel{△}{→}$ Na2SiO3+H2O | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+3H2O2+2H+→I2+O2↑+4H2O | |
| C. | 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(g) $\stackrel{高温}{→}$Fe3O4+4H2 | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气:ClO-+Cl-+2H+→Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol液态KHSO4中含有0.05 NA个阳离子 | |
| B. | 氢氧燃料电池正极消耗22.4 L气体时,电路中通过电子的数目为4 NA | |
| C. | 常温下,100 mL 1 mol•L-l盐酸与4.6 g钠反应生成H2分子数目为0.1NA | |
| D. | 在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
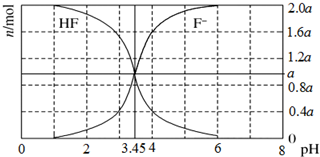 25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | pH=3.45时,溶液中:c(Na+)+c(H+)=c(HF)+c(OH-) | |
| B. | pH=3时,溶液中:c(Na+)>c(F-) | |
| C. | n(F-)=0.6a mol时,溶液中:c(Na+)>c(HF) | |
| D. | pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)=2a mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H+═2Fe3++3H2O | |
| D. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com