

分析 (1)P能级的电子云轮廓是哑铃形,N原子核外电子数为7,根据能量最低原理书写核外电子排布;
(2)金属性越强第一电离能越小;NH4+含有4个δ键,CN-中含有碳氮三键,含有1个δ键和2个π键;
(3)N元素电负性很大,能与水分子之间形成氢键,结合相似相溶原理分析;氢离子含有空轨道,N原子含有孤对电子,通过配位键生成[(CH3)3NH]+;
(4)阳离子[(CH3)3NH]+和阴离子A可按个数比4:1组成化合物,阴离子A中含有4个Ge和10个S,结合电中性可知阴离子为[Ge4S10]4-,结构中6个S原子形成2个共价键,还含有2个孤对电子,其中4个S只形成一个共价键,则还要得到一个电子才能形成8电子稳定结构,含有3对孤电子对,杂化轨道数目均为4;
(5)B原子与周围的4个P原子形成正四面体结构,B原子与晶胞顶点P原子连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,体对角线长度为晶胞棱长的$\sqrt{3}$倍,可以计算晶胞棱长,根据均摊法计算晶胞中原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶体密度.
解答 解:(1)P能级的电子云轮廓是哑铃形,N原子核外电子数为7,核外电子排布式为1s22s22p3,
故答案为:哑铃;1s22s22p3;
(2)Ca为金属,C、N为非金属性,故Ca的第一电离能最小;NH4+含有4个δ键,CN-中含有碳氮三键,含有含有1个δ键和2个π键,故NH4CN中含有5个δ键和2个π键,
故答案为:Ca;5;2;
(3)极性分子(CH3)3N和水之间形成氢键,所以溶解性增强,且二者均为极性分子,相似相溶,
化合物(CH3)3N与盐酸反应生成[(CH3)3 NH]+,氢离子含有空轨道,N原子含有孤对电子,该过程新生成的化学键为氮与质子氢离子形成配位键,
故答案为:(CH3)3N与水分子间形成氢键,(CH3)3N与水均为极性分子,相似相溶;配位键;
(4)阳离子[(CH3)3NH]+和阴离子A可按个数比4:1组成化合物,阴离子A中含有4个Ge和10个S,结合电中性可知阴离子为[Ge4S10]4-,结构中6个S原子形成2个共价键,还含有2个孤对电子,其中4个S只形成一个共价键,则还要得到一个电子才能形成8电子稳定结构,含有3对孤电子对,杂化轨道数目均为4,属于sp3杂化;
故答案为:sp3;[Ge4S10]4-;
(5)B原子与周围的4个P原子形成正四面体结构,B原子与晶胞顶点P原子连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,体对角线长度为晶胞棱长的$\sqrt{3}$倍,晶体中B与P原子的最近距离为a pm,则晶胞棱长为$\frac{4a}{\sqrt{3}}$ pm,晶胞中B原子数目为4,P原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶胞质量为4×$\frac{11+31}{{N}_{A}}$g,则晶体密度为4×$\frac{11+31}{{N}_{A}}$g÷($\frac{4a}{\sqrt{3}}$×10-10 cm)3=$\frac{4×42}{{N}_{A}×(\frac{4a}{\sqrt{3}}×1{0}^{-10})^{3}}$g•cm-3,
故答案为:$\frac{4×42}{{N}_{A}×(\frac{4a}{\sqrt{3}}×1{0}^{-10})^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、化学键、杂化方式、分子结构与性质、晶胞计算等,注意晶胞密度的计算利用均摊法、注意理解同周期主族元素中第一电离能异常原因,理解价层电子对理论与杂化轨道理论.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
 纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂.目前主要的合成方法有电解法、高温固相法等.
纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂.目前主要的合成方法有电解法、高温固相法等.| 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
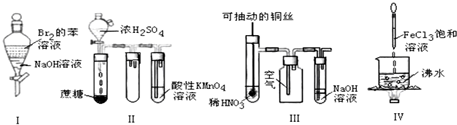
| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:向沸水中滴加FeCl3溶液,继续煮沸溶液至红褐色,就可以制备FeCl3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
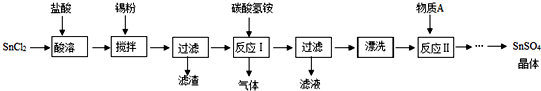
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4晶体 | B. | Cu(NO3)2晶体 | C. | CH3COOK固体 | D. | SO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3 | B. | O2 | C. | H2O | D. | CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com