
 ,D原子的价层电子排布式为3s23p3.
,D原子的价层电子排布式为3s23p3.分析 A原子L层的s、p电子数相等,原子核外电子排布式为1s22s22p2,则A为C元素;B原子2p能级有两对成对电子,原子核外电子排布式为1s22s22p5,则B为F元素;D的原子序数是A的原子序数与B的原子序数之和,D的原子序数为6+9=15,故D为P元素;C与A同主族,且C的原子序数小于磷,故C为Si;E原子的M层和N层电子分别比F原子的M层和N层电子少4个、5个,可知E原子外围电子排布为3d64s2、F原子外围电子排布为4s24p5,则E为Fe、F为Br.
解答 解:A原子L层的s、p电子数相等,原子核外电子排布式为1s22s22p2,则A为C元素;B原子2p能级有两对成对电子,原子核外电子排布式为1s22s22p5,则B为F元素;D的原子序数是A的原子序数与B的原子序数之和,D的原子序数为6+9=15,故D为P元素;C与A同主族,且C的原子序数小于磷,故C为Si;E原子的M层和N层电子分别比F原子的M层和N层电子少4个、5个,可知E原子外围电子排布为3d64s2、F原子外围电子排布为4s24p5,则E为Fe、F为Br.
(1 )A原子核外电子排布式为1s22s22p2,基态原子电子排布图为 ,D为P元素,原子的价层电子排布式为3s23p3,
,D为P元素,原子的价层电子排布式为3s23p3,
故答案为: ;3s23p3;
;3s23p3;
(2)A、C两元素可组成最简式为SiC的化合物,该化合物的晶体类型属于原子晶体,晶体中Si、C原子均形成4个Si-C,Si原子与周围的4个C原子形成正四面体结构,Si、C原子的杂化轨道类型为sp3杂化,键角是109°28′,
故答案为:原子;sp3杂化;109°28′;
(3)B和F的氢化物分别为HF、HBr,HF分子之间存在氢键,沸点高于HBr的;C和D最高价氧化物对应的水化物分别为硅酸、磷酸,P的非金属性比Si的强,则H3PO4的酸性更强,
故答案为:HF;H3PO4;
(4)D与F结合形成PBr3分子,P原子形成3个P-Br键,含有1对孤对电子,该分子的空间构型是三角锥形,
故答案为:三角锥形;
(5)已知单质E的晶胞为体心立方堆积.则:
①该晶胞中含有E原子的数目为1+8×$\frac{1}{8}$=2,故答案为:2;
②晶胞质量为2×$\frac{M}{{N}_{A}}$g,设算E的原子半径为r cm,晶胞体对角线长度为4r cm,棱长为$\frac{4r}{\sqrt{3}}$ cm,晶体的密度为pg/cm3,则2×$\frac{M}{{N}_{A}}$g=pg/cm3×($\frac{4r}{\sqrt{3}}$ cm)3,解得r=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{p{N}_{A}}}$,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{p{N}_{A}}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型判断、晶胞计算等,(5)中计算为易错点、难点,关键是明确原子半径与晶胞棱长关系,需要学生具备一定的数学计算能力.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
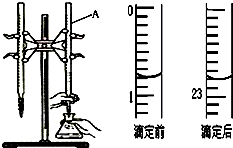 如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×lO-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×lO-3mol•L-1) | 2.70 | 2.15 | 1.95 | 1.85 | 1.80 | 1.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在医疗上碳酸钠可用于治疗胃酸过多 | |
| B. | 家用铁锅用水清洗后置于干燥处,能减缓电化学腐蚀 | |
| C. | 清洁能源所用光电池的生产材料主要是高纯度的二氧化硅 | |
| D. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | l-a | C. | 2-lga | D. | 3-lga |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的化合物,其一氯代物种类(不考虑立体异构)不可能是2种 | |
| B. | 棉花、羊毛、蚕丝均属于天然纤维 | |
| C. | 乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯它们互为同分异构体 | |
| D. | 石油裂化、油脂皂化和煤的干馏都是化学变化,而石油的分馏和蛋白质的盐析都是物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com