
判断下列热化学方程式书写是否正确,正确的划“√”,错误的划“×”(注:焓变数据均正确)
(1)CaCO3(s)===CaO+CO2(g) ΔH=177.7 kJ( )
(2)C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1( )
(3)C(s)+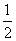 O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-110.5 kJ·mol-1( )
(4)CO(g)+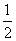 O2(g)===CO2(g)
O2(g)===CO2(g)
ΔH=-283 kJ·mol-1( )
(5)2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1( )
(6)500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)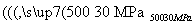 2NH3(g) ΔH=-38.6 kJ·mol-1( )
2NH3(g) ΔH=-38.6 kJ·mol-1( )
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
关于同一种元素的原子或离子,下列叙述正确的是( )
A.原子半径比阴离子半径小
B.原子半径比阴离子半径大
C.原子半径比阳离子半径小
D.带正电荷多的阳离子比带正电荷少的阳离子半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。

(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力,②形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:__________________________________________________。
②表中X可能为以上13种元素中的________(填写字母)元素,则该元素属于________区。用元素符号表示X和j所能形成的化合物的化学式是__________。
③Y是周期表中________族元素。
④以上13种元素中,________(填写字母)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2SO2(g)+O2(g)2SO3(g) ΔH=-196.64 kJ·mol-1,在一定温度下,向一固定容积的密闭容器中通入2 mol SO2、1 mol O2,达到平衡时放出热量为Q1 kJ,在同样条件下,向该容器中通入2 mol SO3,达到平衡时,吸收热量为Q2 kJ,则Q1和Q2的关系为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A.-488.3 kJ·mol-1 B.488.3 kJ·mol-1
C.-191 kJ·mol-1 D.191 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,发生反应:①M(s)+N(g)R(g) ΔH=-Q1 kJ·mol-1,
②2R(g)+N(g)2T(g) ΔH=-Q2 kJ·mol-1。Q1、Q2、Q3均为正值。下列说法正确的是( )
A.1 mol R(g)的能量总和大于1 mol M(s)与1 mol N (g)的能量总和
B.将2 mol R(g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ
C.当1 mol M(s)完全转化为T(g)时(假定无热量损失),放出热量(Q1+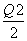 ) kJ
) kJ
D.M(g)+N(g)R(g) ΔH=-Q3 kJ·mol-1,则Q3<Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等。以下是工业上制取纯硅的一种方法。
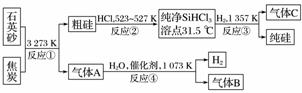
请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有________(填反应代号)。
(2)写出反应③的化学方程式_________________________________________。
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂。将石英砂和纯碱按一定比例混合加热至1 373~1 623 K反应,生成化合物W,其化学方程式是____________________________________。
(4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是__________(填化学式);分别通入W溶液中能得到白色沉淀的气体是______________(填化学式)。
(5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com