
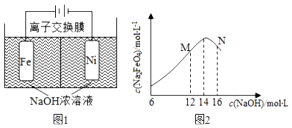
分析 (1)分析碳酸钠溶液中含有阳离子、阴离子,依据放电顺序判断放电离子写出电极反应式,依据电极反应式判断溶液pH变化;
(2)①电解池中阳极发生氧化反应,依据题意可知铁在阳极失去电子,碱性环境下生成高铁酸根离子,据此书写电极反应式;根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原.电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低.
解答 解:(1)碳酸钠溶液中含有阳离子为钠离子与氢离子,氢离子还原性强于钠离子,所以阴极电极反应为:
2H++2e-=H2↑ 或2H2O+2e-=H2↑+2OH-;碳酸钠溶液中含有阴离子为碳酸根离子、氢氧根离子,依据放电顺序可知氢氧根离子在阳极失去电子发生氧化反应,电极反应式为:4OH--4e-=O2↑+2H2O或2H2O-4e-=O2↑+4H+,所以电解实质为电解水,溶液为饱和碳酸钠溶液,电解过程中溶液浓度不变,溶液pH不变;
故答案为:2H++2e-=H2↑ 或2H2O+2e-=H2↑+2OH-;4OH--4e-=O2↑+2H2O或2H2O-4e-=O2↑+4H+; 不变;
(2)①电解池中阳极发生氧化反应,依据题意可知铁在阳极失去电子,碱性环境下生成高铁酸根离子,电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O;
根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,c(OH-)降低的区域在阳极室;
故答案为:Fe-6e-+8OH-=FeO42-+4H2O; 阳极室;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原.电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低,
故答案为:防止Na2FeO4与H2反应使产率降低;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低;
故答案为:N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低.
点评 本题为电化学试题,考查了电解法制取 Na2FeO4,明确电解池工作原理及电极反应式的书写方法是解题关键,题目难度中等.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
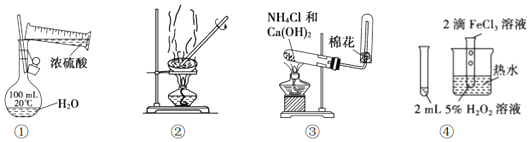
| A. | 用装置①配制一定浓度的硫酸溶液 | |
| B. | 用装置②分离溶解在CCl4中的 I2 | |
| C. | 用装置③制备和收集少量 NH3 | |
| D. | 用装置④验证FeCl3对 H2O2分解有催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
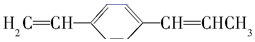 的说法正确的是( )
的说法正确的是( )| A. | 所有原子都在同一平面上 | |
| B. | 最多有4个碳原子在同一直线上 | |
| C. | 有7个碳原子可能在同一直线上 | |
| D. | 最多只能有9个碳原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
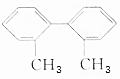 ,请完成下列空白:
,请完成下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入溴的四氯化碳溶液中,溶液褪色 | |
| B. | 光照甲烷和氯气的混合气体后,瓶壁上有油状液滴附着 | |
| C. | 苯滴加到溴水中,震荡后水层接近无色 | |
| D. | 在葡萄糖溶液中加入新制的氢氧化铜,加热后产生砖红色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com