
| A. | 0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大 | |
| B. | 将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的$\frac{1}{2}$ | |
| C. | 相同浓度的HCl和CH3COOH,两溶液中c(H+)相同 | |
| D. | 甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的中c(H+)之比为10:1 |
分析 A、醋酸溶液加水稀释,溶液酸性减弱;
B、一水合氨是弱碱存在电离平衡;
C、盐酸是强酸,醋酸是弱酸存在电离平衡;
D、根据pH=-lg[c(H+)]计算.
解答 解:A、醋酸加水稀释,溶液酸性减弱,氢离子浓度减小,氢氧根离子浓度增大,故A正确;
B、将NaOH溶液和氨水溶液各稀释一倍,氢氧化钠溶液的OH-浓度减少到原来的二分之一,一水合氨存在电离平衡,稀释一倍,电离平衡正向进行,一水合氨溶液的OH-浓度大于原来的二分之一,故B错误;
C、盐酸是强酸,醋酸是弱酸存在电离平衡,如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度比醋酸溶液中氢离子浓度的二倍大,故C错误;
D、甲溶液的pH是5,溶液的c(H+)=10-5mol/L,乙溶液的pH是4,溶液的c(H+)=10-4mol/L,则甲溶液与乙溶液的c(H+)之比为10-5mol/L:10-4mol/L=1:10,故D错误;
故选A.
点评 本题考查了弱电解质电离平衡的分析判断,物质制备和盐类水解的分析应用,掌握基础是关键,题目难度中等.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 92.37% | B. | 9.2% | C. | 50% | D. | 25% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②③ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸稀释时,应将水沿器壁慢慢倒入浓硫酸中,并不断用玻璃棒搅拌 | |
| B. | 浓硫酸不分解,不挥发,所以可以敞口放置于空气中 | |
| C. | 浓硫酸具有氧化性,稀硫酸无氧化性 | |
| D. | 可以用铁罐或铝槽车来运输冷的浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y>M | |
| B. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 | |
| C. | W和Z形成的化合物中阴、阳离子物质的量之比均为1:2 | |
| D. | 由X元素形成的单质不一定是原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/°C | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验内容 | 实验现象 | 实验结论 |
| A | 将几滴水加入蔗糖中并搅拌,再加入浓硫酸,迅速搅拌 | 蔗糖逐渐变黑,体积膨胀,形成疏松多孔的物质 | 只体现了浓硫酸的脱水性 |
| B | 将铜片放入浓硝酸中 | 产生大量红棕色气体,溶液变为蓝绿色 | 体现了浓硝酸的强氧化性和酸性 |
| C | 溴乙烷和氢氧化钠溶液充分反应,用足量稀硝酸酸化,再加入硝酸银溶液 | 生成淡黄色沉淀 | 溴乙烷中含有溴元素 |
| D | 将溴水加入苯中并充分振荡 | 溴水褪色下层有机层为橙红色 | 苯与溴发生了萃取作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物也不是同系物 | |
| B. | 分子式为C7H16的有机物中有三种不同化学环境的氢原子,此有机物一定是2,4-二甲基戊烷或3,3-二甲基戊烷 | |
| C. | 完全燃烧等质量的甲醛、乙酸、葡萄糖、蔗糖消耗的氧气量相等 | |
| D. | 还原性染料靛蓝的结构简式为: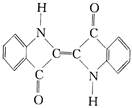 ,它的分子式是:C16H10N2O2 ,它的分子式是:C16H10N2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com