
| A. | 在化工生产中应遵循“绿色化学”的思想 | |
| B. | 通常用来衡量一个国家的石油化学工业发展水平的标志是乙烯的产量 | |
| C. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| D. | 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 |
分析 A.化工生产主要考虑原料的利用率和减少污染性物质的排放;
B.乙烯的产量是衡量一个国家的石油化学工业发展水平的标志;
C.在元素周期表的金属和非金属分界线附近的元素金属性也非金属性都不强,常用于制备半导体材料;
D.F无正价.
解答 解:A.化工生产主要考虑原料的利用率和减少污染性物质的排放,遵循“绿色化学”的思想,故A正确;
B.乙烯的产量是衡量一个国家的石油化学工业发展水平的标志,故B正确;
C.在元素周期表的金属和非金属分界线附近的元素金属性也非金属性都不强,常用于制备半导体材料,故C正确;
D.F无正价,不能形成含氧酸,故D错误.
故选D.
点评 本题考查元素周期律和元素周期表的综合应用,题目难度不大,注意把握元素周期表中元素的分布和应用的关系.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
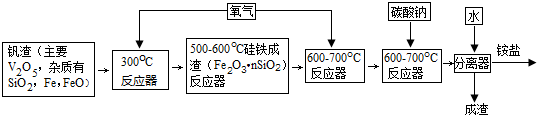
| 温度K | 293 | 373 | 773 |
| 质量(g) | 133.6 | 106.6 | 91.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式相同的不同物质一定是同分异构体 | |
| B. | 通式相同的不同物质一定属于同系物 | |
| C. | 相对分子质量相同的不同物质一定是同分异构体 | |
| D. | 分子式相同,元素的质量分数也相同的物质是同种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
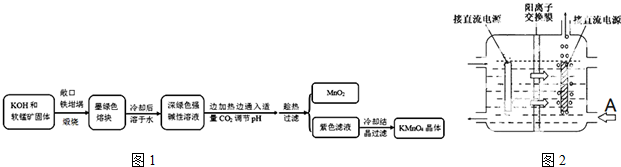
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com