
【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:

①写出H2S的Ka1的表达式:___________
②常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最小的是___________。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是_______________________________。
(2)室温下,用0.100 mol·L-1 盐酸溶液滴定20.00 mL 0.100 mol·L-1 的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化,①②填“>”“<”或“=”)

①a点所示的溶液中c(NH3·H2O)___________c(Cl-)。
②b点所示的溶液中c(Cl-)___________c(NH4+)。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为__________。

(3)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A第二级电离平衡常数Ka2=___________。
【答案】c(H+)×c(HS-)/c(H2S) Na2S H2S+ CO32-=HCO3-+HS- < = 1: 106 10-4.2
【解析】
(1)①多元弱酸分步电离,H2S是一个二元弱酸,Ka1=c(H+)×c(HS-)/c(H2S);
②酸的电离平衡常数越大,酸性越强,对应的酸根离子的水解能力越弱;
③利用强酸制弱酸;
(2)①a点加入的盐酸体积为氨水体积的1/2,混合液中含有等浓度的NH3·H2O和NH4Cl,结合图象判断出NH3·H2O的电离程度大于NH4+的水解程度;
②由电荷守恒可知c(NH4+)+c(H+)=c(Cl-)+c(OH-),溶液呈中性,c(H+)=c(OH-),所以c(NH4+)=c(Cl-);
③NH3·H2O是一元弱碱,对水的电离起到抑制作用,NH4Cl是强酸弱碱盐,促进水的电离;
(3)由图象可知,pH=4.2时,c(HA-)=c(A2-),Ka2=c(A2-)×c(H+)/ c(HA-)= 10-4.2。
(1)①H2S是一个二元弱酸,Ka1=c(H+)×c(HS-)/c(H2S);
②常温下,K(HF) >Ka2(H2CO3) > Ka2(H2S),酸越弱,对应的酸根离子的水解能力越强,故物质的量浓度相同的NaF、Na2CO3、Na2S三种溶液,pH(Na2S) >pH(Na2CO3) >pH(NaF),所以常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最小的是Na2S。
③因为Ka1(H2CO3) > Ka1(H2S) >Ka2(H2CO3) > Ka2(H2S),由强酸制弱酸可知,将过量H2S通入Na2CO3溶液,反应的离子方程式:H2S+ CO32-=HCO3-+HS-。
(2)①a点加入的盐酸体积为氨水体积的1/2,等浓度的两溶液反应后,混合液中含有等浓度的NH3·H2O和NH4Cl,由于NH3·H2O的电离程度大于NH4+的水解程度,则溶液显示碱性,故a点所示的溶液中c(NH3·H2O) <c(Cl-);
②由电荷守恒可知c(NH4+)+c(H+)=c(Cl-)+c(OH-),因为pH=7,溶液呈中性,c(H+)=c(OH-),所以c(NH4+)=c(Cl-);
③NH3·H2O是一元弱碱,对水的电离起到抑制作用,故室温下pH=11的氨水由水电离出的c(H+)= 1.0×10-11mol·L-1;NH4Cl是强酸弱碱盐,促进水的电离,故室温下pH=5的NH4Cl溶液中,由水电离出的c(H+)= c(H+)= 1.0×10-5mol·L-1,所以室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为(1.0×10-11mol·L-1):(1.0×10-5mol·L-1)=1: 106;
(3)由图象可知,pH=4.2时,c(HA-)=c(A2-),Ka2=c(A2-)×c(H+)/ c(HA-)= 10-4.2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了测定某铁碳合金中铁的质量分数,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
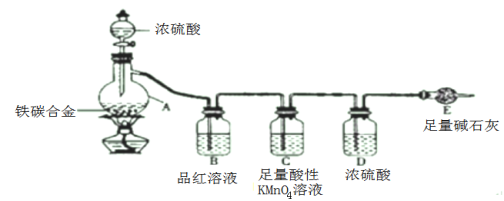
(1)按图示的连接装置,检查装置的气密性并称量E的质量。将10克铁碳合金样品放入A中,再加入适量的浓硫酸,仪器A的名称为_________________。未点燃酒精灯前,A、B均无明显现象 。
(2)点燃酒精灯一段时间后,A、B中可观察到明显的现象。写出A中浓硫酸参与反应的化学方程式 __________________(任写一个)。C装置的作用是 _____________ 。
(3)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________。
(4)待A中不再逸出气体时,停止加热,拆下E并称重。E增重1.1克。则铁碳合金中铁的质量分数为 _________________ 。
(5)该装置存在一些缺陷,使得测定结果可能会产生误差,请指出该装置的缺陷__________ 、 __________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是

A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.酸性碘化钾溶液中滴加适量双氧水:2I-+2H++H2O2=I2+2H2O
B.用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
C.向苯酚钠溶液中通入少量CO2,溶液变浑浊:2![]() +CO2+H2O=2
+CO2+H2O=2![]() +CO32-
+CO32-
D.铅蓄电池充电时阴极反应式:PbSO42e-+2H2O=PbO2+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合液25mL,向其中逐渐加入铁粉,产生气体的物质的量随铁粉质量增加的变化如图所示(硝酸的还原产物为NO,忽略反应中的溶液体积变化)。下列有关说法错误的是( )

A.OA段产生的气体是NO,AB段发生的反应为Fe+2Fe3+=3Fe2+,BC段产生的气体是H2
B.由此推断该条件下,氧化性:NO3-强于Fe3+
C.OA段与BC段产生的气体的体积比为1:1
D.C点溶质的物质的量浓度为10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素[CO(NH2)2] 是首个由无机物合成的有机化合物,通常用作植物的氮肥。合成尿素的主要反应如下:
i. 2NH3(l) + CO2(g) ![]()
![]() (l)(氨基甲酸铵) △H=-a kJ/mol
(l)(氨基甲酸铵) △H=-a kJ/mol
ii. ![]() (l)
(l) ![]()
![]() (l) + H2O(l) △H=+b kJ/mol
(l) + H2O(l) △H=+b kJ/mol
iii. 2![]()
![]()
![]() (缩二脲)+NH3 (副反应,程度较小)
(缩二脲)+NH3 (副反应,程度较小)
(1)实验室制取氨气的化学方程式是__________________。
(2)CO(NH2)2中C为+4价,N的化合价_______。
(3)CO2和NH3合成尿素的热化学方程式为___________________________。
(4)工业上提高氨碳比(![]() ),可以提高尿素的产率,结合反应i~iii,解释尿素产率提高的原因______。
),可以提高尿素的产率,结合反应i~iii,解释尿素产率提高的原因______。
(5)某科研小组模拟工业合成尿素,一定条件下,在0.5L的密闭容器中投入4molNH3和1molCO2,测得反应中各组分的物质的量随时间变化如图1所示:

①反应进行到10min时,用CO2表示反应i的速率υ(CO2)=________。
②合成总反应的快慢由慢的一步决定,则合成尿素的总反应的快慢由第______步反应决定(填“i”或“ii”)。
(6)我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图2)。总反应为:CO(NH2)2+H2O![]() 3H2↑+N2↑+CO2↑。
3H2↑+N2↑+CO2↑。
①A电极连接电源的_______极(填“正”或“负”)。
②A电极的电极反应为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1日是中华人民共和国成立 70 周年,国庆期间对大量盆栽鲜花施用了S-诱抗素制剂以保证鲜花盛开,利用如图所示的有机物X可生产S-诱抗素Y。下列说法不正确的是( )
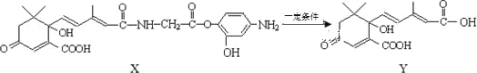
A.1mol Y 与足量 NaOH 溶液反应,最多消耗 2mol NaOH
B.Y 的分子式为 C15H19O6
C.1mol Y最多与 4mol H2 发生加成反应
D.X 可以发生氧化、取代、酯化、加聚、缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

根据以上工艺流程图,回答下列问题:
(1)提高焙烧效率的方法有______________________________。(写任意一种即可)
(2) “焙烧”时MoS2转化为MoO3,该反应的氧化产物是________。
(3) “碱浸”时生成CO2的电子式为________,“碱浸”时含钼化合物发生的主要反应的离子方程式为____________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为__________________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO![]() )=0.20 mol·L-1,c(SO
)=0.20 mol·L-1,c(SO![]() )=0.01 mol·L-1。“结晶”前应先除去SO
)=0.01 mol·L-1。“结晶”前应先除去SO![]() ,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO
,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO![]() 的质量分数为________%。[已知Ksp(BaSO4)=1×10-10,Ksp(BaMoO4)=2.0×10-8]
的质量分数为________%。[已知Ksp(BaSO4)=1×10-10,Ksp(BaMoO4)=2.0×10-8]
(6)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO![]() 生成,该反应的离子方程式为__________________________。
生成,该反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉末状试样A是由![]() 和Fe2O3组成的混合物。进行如下实验:
和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取![]() 全部溶于
全部溶于![]() 盐酸中,固体全部溶解,得溶液C;
盐酸中,固体全部溶解,得溶液C;
③将①中得到的单质B和溶液C反应,放出![]() (标况)气体。同时生成溶液D,还残留有固体物质B;
(标况)气体。同时生成溶液D,还残留有固体物质B;
④用![]() 溶液检查时,溶液D不变色。
溶液检查时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是____________,产物中的单质B是___________________。
(2)②中所发生反应的化学方程式是____________、____________。
(3)③中所发生反应的离子方程式是____________、____________。
(4)若溶液D的体积仍视为![]() ,则该溶液中
,则该溶液中![]() 为____________,
为____________,![]() 为____________。
为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com