
【题目】下列离子方程式正确的是( )
A.二氧化硅溶于氢氟酸溶液中: SiO2+4H++4F-=SiF4↑ +2H2O
B.偏铝酸钠溶液中通入过量的CO2:2AlO2- + CO2+3H2O=2Al(OH)3↓+ CO32-
C.稀硫酸加入氢氧化钡溶液中:H+ +![]() + Ba2+ + OH-=BaSO4↓+ H2O
+ Ba2+ + OH-=BaSO4↓+ H2O
D.硫酸铝溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室利用铜和稀硝酸制备一氧化氮:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,该反应的离子方程式为___。每生成11.2LNO(标准状况),转移的电子数为___NA。
Ⅱ.(1)在发射“神舟”十一号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时即产生气体,并放出大量的热。已知:
N2H4(l)+2H2O2(l)==N2(g)+4H2O(g) ΔH1;
H2O(l)==H2O(g) ΔH2
请写出液态肼与足量过氧化氢反应生成氮气和液态水的热化学方程式:_____。
(2)在25℃,101kPa下,1molCO完全燃烧放出283.0kJ的热量。请写出表示CO燃烧热的热化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以重晶石(BaSO4)为原料,可按如下工艺生产立德粉(ZnS·BaSO4):
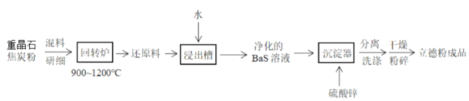
下列说法不正确的是
A.在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为BaSO4+4C![]() BaS+4CO↑
BaS+4CO↑
B.回转炉尾气中含有有毒气体,生产上可通过水蒸气变换将其转化为CO2和一种清洁能源气体,该反应的化学方程式为CO+H2O![]() CO2+H2
CO2+H2
C.在潮湿空气中长期放置的“还原料”。会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的BaSO4
D.沉淀器中发生的离子反应方程式为:S2-+Ba2++Zn2++SO42-=ZnS·BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(![]() )中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A. 电解质溶液中混入水,对电池反应无影响
B. 金属锂作电池的正极,石墨作电池的负极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D. 电池工作过程中,金属锂提供的电子与正极区析出的硫的物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
A. 碳酸氢钠溶液直接蒸干得到碳酸氢钠固体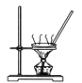
B. 制备Fe(OH)2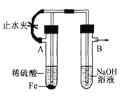
C. 除去CO2中含有的少量HCl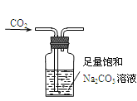
D. 配制100mL 0.1mol/L的稀硫酸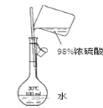
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:H2(g) + I2(g)![]() 2HI(g) ΔH<0,现有三个相同的1 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 molHI(g) ,在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
2HI(g) ΔH<0,现有三个相同的1 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 molHI(g) ,在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A. 容器Ⅰ、Ⅱ中正反应速率相同
B. 容器Ⅰ、Ⅲ中反应的平衡常数相同
C. 容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色深
D. 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用如图装置做以下两个实验:
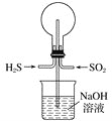
①常温下将H2S和SO2以物质的量之比为1∶1充满烧瓶,不久,烧瓶中能观察到的现象是_______。
②若用Cl2代替SO2,其他条件不变,观察到的现象与①相同之处为______,不同之处为_____;试用简要文字和化学方程式解释原因: ______。
③若想使②中反应后,烧瓶内产生“喷泉”现象,引发的操作为________。
(2)某课外活动小组利用如图所示装置进行实验:
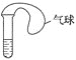
在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,因此溶液可能是_____溶液;加热时溶液由无色变为红色的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的反应热,表示燃烧热的是( )
A. NH3(g)+![]() O2(g)
O2(g)![]()
![]() N2(g)+
N2(g)+![]() H2O(g) ΔH=-a kJ·mol-1
H2O(g) ΔH=-a kJ·mol-1
B. C6H12O6(s)+6O2(g)![]() 6CO2(g)+6H2O(l) ΔH=-b kJ·mol-1
6CO2(g)+6H2O(l) ΔH=-b kJ·mol-1
C. C(s) +H2O(g) == CO(g)+H2(g) H=-c kJ·mol-1
D. CH3CH2OH(l)+![]() O2(g)
O2(g)![]() CH3CHO(l)+H2O(l) ΔH=-d kJ·mol-1
CH3CHO(l)+H2O(l) ΔH=-d kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
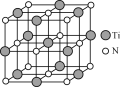
【题目】金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为_____。
②与BH4-互为等电子体的阳离子的化学式为_____。
③H、B、Ti原子的第一电离能由小到大的顺序为_____。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
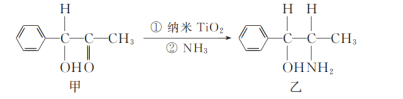
化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为____。
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com