
【题目】贵州的矿产资源丰富,在全国占优势地位的有铝、磷、煤、锰、重晶石、黄金、铅锌、锑等众多品种。回答下列问题:
(1)金元素属于铜族元素,原子结构与铜相似,在元素周期表中位于第六周期,基态金原子的外围电子排布图为__________;Cu2+能与多种离子或分子形成稳定性不同的配合物。经X射线衍射测得配合物酞菁铜的晶体结构,其局部结构如图所示:
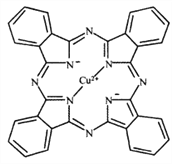
①酞菁铜结构中非金属元素电负性由大到小的顺序为__________;
②酞菁铜结构中N原子的轨道杂化类型为__________。酞菁铜结构中不存在的化学键类型为__________
A.配位键 B.金属键 C.σ键 D.π键
(2)煤通过干馏、气化、液化可获得清洁燃料和多种化工原料,氨是其中之一。NH3的 VSEPR模型为__________。
(3)锰、铁两元素中第三电离能较大的是__________(填元素符号),原因是___________。
(4)碲化锌(ZnTe)具有宽禁带的特性,常用于制作半导体材料,碲化锌晶体有立方和六方两种晶型,其立方晶胞结构如下图所示。
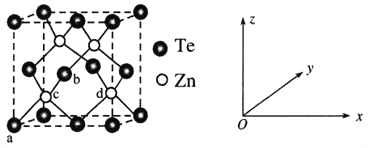
①原子坐标参数表示晶胞内部各原子的相对位置。已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() )。则d的原子坐标参数为__________。
)。则d的原子坐标参数为__________。
②若两个距离最近的Te原子间距离为apm,则晶体密度为__________g/cm3(列式即可)。
【答案】  N>C>H sp2;sp3 B 四面体 Mn Mn失去的是半充满的3d5电子,而Fe失去的是3d6电子,所以Mn的第三电离能大
N>C>H sp2;sp3 B 四面体 Mn Mn失去的是半充满的3d5电子,而Fe失去的是3d6电子,所以Mn的第三电离能大 ![]()
![]() 或
或![]()
【解析】(1)金元素属于铜族元素,原子结构与铜相似,在元素周期表中位于第六周期。铜是3d104s1,基态金原子应是5d106s1,故其的外围电子排布图为 ;
;
①酞菁铜结构中非金属元素有C、N、H,电负性由大到小的顺序为N>C>H;
②酞菁铜结构中N原子有两种,一种有3对价层电子对,另一种有4对价层电子对,故其轨道杂化类型为sp2;sp3;酞菁铜结构中有配位键、σ键、π键,没有金属键,故选B;
(2)NH3的 VSEPR模型为四面体;
(3)锰、铁两元素中第三电离能是在Mn2+、Fe2+的基础上再失一个电子消耗的能量,Mn2+的外围电子排布式为:3d5,Fe2+的外围电子排布式为:3d6,Mn2+为半充满,更稳定故其第三电离能较大;
(4)①碲化锌立方晶胞结构和金刚石的晶胞类似,d原子均位于体对角线的四分之一处,c的原子坐标参数为 (![]() ,
,![]() ,
,![]() ),在晶胞左下角,d则在右下角位置,故其坐标为
),在晶胞左下角,d则在右下角位置,故其坐标为![]() ;
;
②两个距离最近的Te原子间距离为晶胞面对角线的一半,是apm,故晶胞边长为:![]() pm,一个晶胞中有4个Te,4个Zn,故晶胞密度为:
pm,一个晶胞中有4个Te,4个Zn,故晶胞密度为:![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖由三位化学家共同获得,以表彰他们在研究纳米分子机器中的“马达分子”取得的成就,“马达分子”的关键组件是三蝶烯(图1),下列说法正确的是
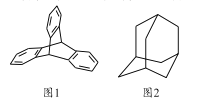
A. 三蝶烯的分子式为C20H16 B. 三蝶烯属于苯的同系物
C. 金刚烷(图2)属于饱和烃 D. 三蝶烯和金刚烷的一氯代物均只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为:N2+3H2![]() 2NH3,该反应在一定条件下的密闭容器中进行。下列关于该反应的说法正确的是( )
2NH3,该反应在一定条件下的密闭容器中进行。下列关于该反应的说法正确的是( )
A. 达到平衡时,反应速率:v(正)=v(逆)=0
B. 使用催化剂可加快反应速率,提高生产效率
C. 为了提高H2的转化率,应适当增大H2的浓度
D. 若在密闭容器加入1molN2和过量的H2,最后能生成2molNH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代混合动力车目前一般使用镍氢电池(M表示储氢合金;汽车在刹车或下坡时,电池处于充电状态)。镍氢电池充放电原理的示意图如下:

其总反应式为![]() 。根据所给信息判断,下列说法错误的是
。根据所给信息判断,下列说法错误的是
A. 混合动力汽车上坡或加速时,乙电极的电极反应式为:NiOOH+H2O+eˉ==Ni(OH)2+OHˉ
B. 混合动力汽车上坡或加速时,电解液中OHˉ向甲电极移动
C. 混合动力汽车下坡或刹车时,甲电极周围溶液的pH减小
D. 混合动力汽车下坡或刹车时,电流的方向为:甲电极→发动机→乙电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是关于细胞中水和无机盐的叙述,其中正确的是
A. 越冬植物的细胞内自由水含量较高
B. 不同细胞内自由水与结合水的比例基本相同
C. 急性肠炎病人除补水外还需要补充一些无机盐
D. 营养性贫血患者体内肯定缺乏Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:NOx能与Na2O2反应;NO和NO2均能与酸性KMnO4溶液反应生成NO3ˉ和Mn2+。
I.用下图所示装置(略去夹持仪器)可制得少量亚硝酸钠(2NO+Na2O2=2NaNO2)。

(1)B、D的仪器名称是________,D的作用是________。
(2)通NO前,需先通一段时间N2,目的是________,
(3)E中主要反应的离子方程式为________,
(4)常温下,测得实验前后C的质量差值为0.30g,则制得NaNO2________g。
Ⅱ.NO2和Na2O2都有较强氧化性,为探究NO2与Na2O2反应的产物,提出如下假设:
假设i.NO2氧化Na2O2;假设ii.Na2O2氧化NO2。
甲同学设计如图所示实验装置:

请回答下列问题:
(5)单向阀在实现气体单向流通的同时,还有一个作用是___________。
(6)待试管G中收集满气体,向试管G中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃,甲同学据此认为假设i正确。乙同学认为该装置不能达到实验目的,为达到实验目的,应在F、G之间增加一个M装置,M中应盛装__________(可供选择的试剂:碱石灰,浓硫酸饱和氯化钠溶液);乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得到结论:假设ⅱ正确。
请做出正确判断,写出NO2和Na2O2反应的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近两年流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品。苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为![]() ,下列说法不正确的是
,下列说法不正确的是
A. 苹果酸在一定条件下能发生酯化反应
B. 苹果酸在一定条件下能发生催化氧化反应
C. 苹果酸在一定条件下能发生取代反应
D. 1 mol苹果酸与Na2CO3溶液反应最多消耗1 mol Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com