
(1)在A中加入足量的甲醛溶液,并在水浴中加热,反应完全后,得到沉淀物2.16 g。
(2)B洗涤、干燥后,质量为10.7 g ,用100 mL 4 mol·L-1HCl溶液可使B恰好完全溶解。
试计算混合物中Mg2+、Al3+和Ag+的物质的量浓度。
科目:高中化学 来源: 题型:
NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
用该蓄电池进行电解M(NO3)x溶液时:
(1)电解池的阳极(惰性)应该接________________(填序号)
A.NiO2 B.Fe
C.Fe(OH)2 D.Ni(OH)2
若此时蓄电池工作一段时间消耗
(2)电解M(NO3)x溶液时,某一极增至m g,金属M的相对原子质量的计算式为_____________。(用m、x表示)
(3)此蓄电池电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100 mL,阳极产生气体的体积_____________L(标准状况),电解后溶液加水稀释至
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)若此蓄电池放电时,该电池某一电极发生还原反应的物质是____________(填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)假如用此蓄电池分别用来电解以下两种溶液,工作一段时间后都分别消耗
①电解M(NO3)x溶液时某一极增加了a g M,则金属M的相对原子质量的计算式为__________________(用“a、x表示)。
②电解含有0.1 mol CuSO4和0.1 mol NaCl的混合溶液100 mL,阳极产生标准状况气体_____________L;将电解后溶液加水稀释至
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁盘锦第二高中高二第二次阶段考试化学试卷(带解析) 题型:填空题
(14分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)______________ , ______________ , _______________。
(3)以下各小题均为常温下的溶液
j某溶液中由水电离的c(H+)=10-10mol·L-1,则该溶液的pH为__________。
k盐类水解的逆反应是中和反应 (填“对”或“错”)
lHCO3—溶液呈碱性说明HCO3—的电离能力弱于水解能力 (填“对”或“错”)
m盐溶液显酸碱性,一定是由水解引起的 (填“对”或“错”)
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)  Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 ml蒸馏水 ②100 mL 0.3 mol·lL-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为_______________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
查看答案和解析>>
科目:高中化学 来源:2016届四川省广安市高一上学期期末考试化学试卷(解析版) 题型:填空题
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此回答下列问题:
(1)图中涉及分离溶液与沉淀的方法是__________________。
(2)B、C、D 三种物质的化学式为:B_________ C_________ D_________
(3)沉淀E与稀硫酸反应的离子方程式为________________________________________。
(4)将沉淀F中存在的两种金属元素组成的合金溶于100 mL 4mol/LHCl溶液中,然后再滴加1 mol/L NaOH溶液,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。
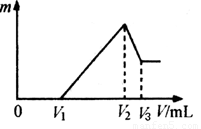
已知V1=160mL。根据以上信息回答:
①_________(填“能”或“不能”)计算出V3
②V2为_________mL(若能算出具体数字,请在横线上填写具体数字;若不能请在横线上填“不能确定”)
查看答案和解析>>
科目:高中化学 来源:2014届江苏省海门市高三第一次诊断考试化学试卷(解析版) 题型:实验题
下列有关物质性质应用的说法正确的是
A.SO2具有漂白性,可用作熏蒸粉丝使其增白
B.常温下二氧化硅不与强酸反应,可用石英容器盛放氢氟酸
C.铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀
D.氧化铝熔点很高,可用作制造高温耐火材料,如制耐火砖、坩埚等常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:

已知:几种化合物的溶解度(S)随温度(T)变化曲线如下图所示。

(1)过滤时主要玻璃仪器有 。加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是: 。
(3)“调节pH=4”可选用的试剂是 (填编号)
①MgO ②CuO ③稀NaOH溶液
④Mg ⑤稀硫酸 ⑥MgCO3
(4)反应II为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量m g产品配成100 mL溶液。
步骤2:取10 mL溶液于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7标准溶液滴定未被氧化的Fe2+。记录消耗K2Cr2O7溶液的体积。
①步骤2中发生反应的离子方程式为: 。
②若配制K2Cr2O7标准溶液时未洗涤烧杯,则产品中Mg(ClO3)2·6H2O的含量会 。(填“偏高”、“偏低” 或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com