
A、氯化钠的电子式: |
B、Cl-的结构示意图: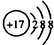 |
| C、乙烯的结构式:C2H4 |
D、CH4分子的比例模型: |
 ,故A正确;
,故A正确;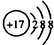 ,故B正确;
,故B正确;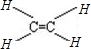 ,故C错误;
,故C错误; ,故D正确;
,故D正确;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
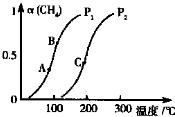 天然气在工农业生产中具有重要意义.
天然气在工农业生产中具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
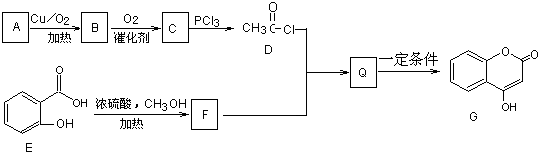
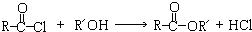
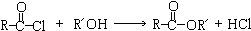 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
A、12C和14C的原子结构示意图均为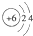 |
| B、在Na2O2和CaCl2中均含有共价键和离子键 |
C、结构示意图为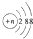 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
D、电子式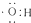 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用活性炭去除冰箱中的异味 |
| B、用热碱水清除炊具上残留的油污 |
| C、用浸泡过高锰酸钾溶液的硅藻土保存水果 |
| D、用含碱石灰的透气小袋与食品一起密封包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:
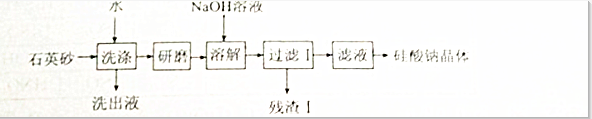
查看答案和解析>>
科目:高中化学 来源: 题型:

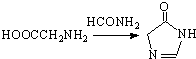
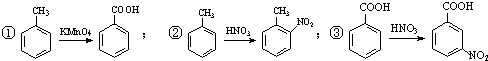
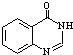 .合成过程中无机试剂任选;合成路线流程图示例为:CH3CH2OH
.合成过程中无机试剂任选;合成路线流程图示例为:CH3CH2OH| H2SO4 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
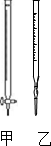 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com