
部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法不正确的是( )
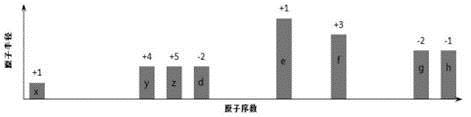
A. 简单离子半径的大小顺序g>h>e>f
B. 与x 形成化合物的沸点:d>z>y
C. zh3中各原子均满足8电子结构
D. x、y、z、d四种元素各自最高价和最低价代数和分别为0、0、2、4
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末理科化学A卷(解析版) 题型:选择题
下列物质中,含有非极性键的共价化合物是( )
A.CH3CH3 B.Na2O2 C.NaCl D.N2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二下第二次月考化学试卷(解析版) 题型:选择题
某有机物A的化学式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有
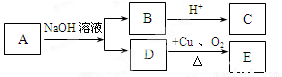
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春十一高三下考前冲刺理综化学试卷二(解析版) 题型:选择题
Wolff-Kishner-黄鸣龙反应是醛类或酮类在碱性条件下与肼作用,使得>C=O转化为-CH2-。如:
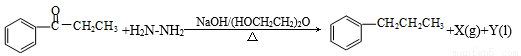
其中,X和Y不污染环境,下列说法中不正确的是( )
A.肼作还原剂
B.X是N2
C.Y是H2O
D.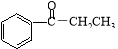 在酸性条件下水解为苯甲酸和乙醇
在酸性条件下水解为苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三毕业班最后一卷理综化学试卷(解析版) 题型:实验题
“侯氏制碱法”是我国化工行业历史长河中一颗璀璨明珠。
Ⅰ..纯碱的制备:用下图装置制取碳酸氢钠,再间接制得纯碱。
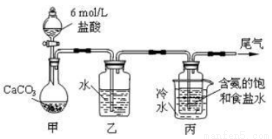
(1)装置乙的作用是 _________________,其中水可以用_______________代替;
(2)装置丙中反应的化学方程式为_____________________________________;
(3)用装置丙中产生的碳酸氢钠制取纯碱时,需要的实验操作有:_____________。
(4)定量分析:测定纯碱样品纯度
提供药品:酚酞、甲基橙、0.1mol/LHCl溶液
实验步骤:
①称取样品mg,溶于水形成100mL溶液;
②向溶液中滴加少量___________作指示剂,再向其中滴加盐酸溶液至终点,消耗盐酸_________VmL;
③计算:纯碱样品纯度=__________________。
Ⅱ.某小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去。为探究原因,进行了下列实验:加热0.1mol/LNaHCO3溶液,测得溶液pH随温度变化的曲线:
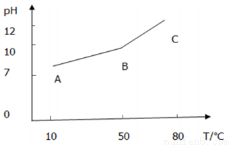
当温度恢复到10℃,测得溶液 pH=11.5。
(5)依据图像信息对下列问题做出合理猜测:
①AB段pH上升原因:____________________________________________________,
②BC段pH上升原因:____________________________________________________;
(6)设计实验对BC段pH上升的合理猜测进行验证(药品任意选择):__________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二5月月考化学试卷(解析版) 题型:实验题
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱之一。下面是它的一种实验室合成路线:
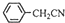 +H2O+H2SO4
+H2O+H2SO4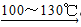
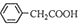 +NH4HSO4
+NH4HSO4
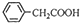 +Cu(OH)2→(
+Cu(OH)2→(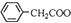 )2Cu+H2O
)2Cu+H2O
已知:苯乙腈的熔点为-23℃,不溶于水;
苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇.
回答下列问题:
(1)制备苯乙酸的装置示意图如图(加热和夹持装置等略):在250mL三口瓶a中加入70mL 70%硫酸.配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是__________;
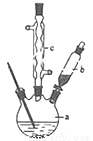
(2)将a中的溶液加热至100℃,再由b缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应.在装置中,仪器c的名称是__________;其作用是__________;
(3)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是__________,下列仪器中可用于分离苯乙酸粗品的是__________;
A.分液漏斗 |
B.漏斗 |
C.烧杯 |
D.直形冷凝管 |
E.玻璃棒
(4)提纯苯乙酸的方法是__________,最终得到44g纯品,则苯乙酸的产率是__________;
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是__________;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二5月月考化学试卷(解析版) 题型:选择题
常温下,饱和NaClO溶液的pH约为11。某消毒液的主要成分为NaClO,洁厕灵主要成分为HCl。下列解释相关事实的离子方程式中不合理的是
A.该消毒液加白醋生成HClO,可增强消毒能力:H++ClO-=HClO
B.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=ClO-+Cl-+H2O
C.常温下,该消毒液的pH≈11,是因为:ClO-+H2O HClO+OH-
HClO+OH-
D.该消毒液与洁厕灵混用会引起中毒:2H++Cl-+ClO-=Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一下第二次月考化学试卷(解析版) 题型:选择题
下列排列顺序不正确的是()
A. 热稳定性:HF>HCl>HBr B. 碱性:Ca(OH)2>Mg(OH)2
C. 元素金属性:Na>Mg>Al D. 酸性:H3PO4>H2SO4>HClO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com