
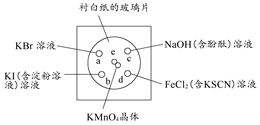
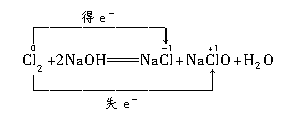


科目:高中化学 来源:不详 题型:实验题
| | 选用试剂 | 实验现象 |
| 方案1 | | |
| 方案2 | | |
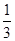 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由反应可确定氧化性:HClO3>O2 |
| B.由非金属性:Cl>S,可推知酸性:HClO3>H2SO4 |
| C.若氯酸分解所得1 mol混合气体的质量为45 g,则反应方程式可表示为3HClO3=2O2↑+Cl2↑+HClO4+H2O |
| D.若化学计量数a=8,b=3,则生成3 mol O2时该反应转移20 mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两个实验中溶液的pH变化趋势相同 |
| B.两实验中生成等量I2时,转移电子数的物质的量相同 |
| C.在实验Ⅰ的过程中,若NaHSO3初始量为3mol,当溶液中I¯与I2的物质的量之比为5∶2时,氧化产物为3.2mol |
| D.过程Ⅱ中,可以用淀粉作为滴定指示剂,判定第一阶段的反应终点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.滴加KI溶液时,KI被氧化,CuI是还原产物 |
| B.通入SO2后,溶液变无色,体现SO2的还原性 |
| C.整个过程发生了复分解反应和氧化还原反应 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
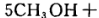
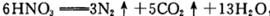 下列说法正确的是
下列说法正确的是| A.CH3OH被氧化,表现氧化性 |
| B.此条件下还原性强弱为:N2>CH3OH |
| C.若氧化产物比还原产物多0.2 mol,则该反应中转移3 mole- |
| D.该反应过程中断裂的化学键既有极性键又有非极性键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O| A.反应(1)和(2)均为氧化还原反应 |
| B.反应(1)的氧化剂是O2,还原剂是FeO?Cr2O3 |
| C.高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D.反应(1)中每生成1molNa2CrO4时电子转移3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com