
分析 (1)H2S具有强还原性,Fe3+具有较强的氧化性,可以将S2-氧化成S单质;
(2)n(NaOH)=1L×0.2amol/L=0.2amol,n(H2S)=$\frac{2.24aL}{22.4L/mol}$=0.1amol,二者恰好发生2NaOH+H2S=Na2S+2H2O,Na2S为强碱弱酸盐,水解呈碱性;
结合Ksp=c(Cl-)×c(Ag+)计算,注意体积的变化;
(3)由总方程式可知,反应中S元素化合价升高,H2S被氧化,O元素化合价降低被还原,则通入H2S的一极为负极,被氧化生成SO32-;
(4)结合电解方程式2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4、2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-、2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2计算.
解答 解:(1)H2S具有强还原性,Fe3+具有较强的氧化性,可以将S2-氧化成S单质,本身被还原成Fe2+,由于H2S是弱电解质,故书写离子方程式时,应写其分子式,即2Fe3++H2S═S↓+2Fe2++2H+,故答案为:2Fe3++H2S═S↓+2Fe2++2H+;
(2)n(NaOH)=1L×0.2amol/L=0.2amol,n(H2S)=$\frac{2.24aL}{22.4L/mol}$=0.1amol,二者恰好发生2NaOH+H2S=Na2S+2H2O,Na2S为强碱弱酸盐,水解呈碱性,水解方程式为S2-+H2O?HS-+OH-,
溶液中的c(Cl-)=2.0×10-8mol/L,则混合后生成沉淀时c(Ag+)=$\frac{1.8×1{0}^{-10}}{2.0×1{0}^{-8}}$mol/L=9×10-3mol/L,
则混合前c(Ag+)=9×10-3mol/L×2=1.8×10-2mol/L,
故答案为:碱性;S2-+H2O?HS-+OH-;1.8×10-2mol/L;
(3)由总方程式可知,反应中S元素化合价升高,H2S被氧化,O元素化合价降低被还原,则通入H2S的一极为负极,负极发生2H2S+16OH--12e-=2SO32-+10H2O,
故答案为:2H2S+16OH--12e-=2SO32-+10H2O;
(4)分别电解足量的硫酸铜溶液,硫酸钠溶液,氯化钠溶液,由电解方程式2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4、2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2、2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-可知电解后硫酸铜生成硫酸,溶液酸性增强,则pH减小,硫酸钠为中性溶液,pH不变,氯化钠溶液生成NaOH,pH增大,
假设转移2mol电子,则硫酸铜溶液生成0.5molO2,硫酸钠溶液生成1molH2和0.5molO2,氯化钠溶液生成1mol氯气和1mol氢气,体积比为0.5:1.5:2=1:3:4,
故答案为:变小;不变;变大;1:3:4.
点评 本题考查较为综合,涉及物质的分离、检验以及电解池等知识,侧重于学生的分析能力、实验能力和计算能力的考查,为高频考点,注意把握实验的原理和原电池的工作原理,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水含有NA个水分子 | |
| B. | 氧气和臭氧的混合物32 g中含有NA个氧原子 | |
| C. | 7.8g Na2O2与水反应时转移0.1NA个电子 | |
| D. | 1.12L氯气中含有NA个氯原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、盐酸 | B. | NaOH溶液、CO2 | ||
| C. | NaHCO3溶液、石灰水 | D. | Na2O2、稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:推断题
[化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________,D原子的杂化类型为_______________。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________(填“大于”、“小于”、或“等于”)N的沸点,原因是_______________。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________。写出相应的化学反应方程式:____________________。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________,加入乙醇的作用是________________。
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______g.cm-3

查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:选择题
某同学用图Ⅰ所示的装置验证一些物质的性质。下列说法错误的是
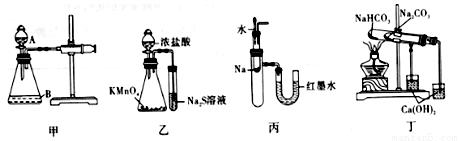
A.图甲中,为检查装置的气密性,可关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
B.图已中,可以比较KMnO4、Cl2和S氧化性的相对强弱
C.将胶头滴管中的水滴入到金属钠中,能看到U型管右侧红墨水上升
D.图丁中,可用装置验证NaHCO3和Na2CO3的热稳定性强弱
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入稀硝酸,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
C | 铝箔插入稀硝酸中 | 无现象 | 铝箔表面被HNO3氧化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期期中化学试卷(解析版) 题型:选择题
从下列实验操作、现象得出的相应结论不正确的是
选项 | 实验操作、现象 | 结论 |
A | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体;另取原溶液少许,向其中滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
B | 氯水中存在多种分子和离子,向新制氯水中加入有色布条,片刻后有色布条褪色 | 说明氯水中有HClO存在 |
C | 将淀粉与KCl混合液装于半透膜内,浸泡在盛蒸馏水的烧杯中,5min后取烧杯中液体,加碘水变蓝色 | 证明半透膜有破损 |
D | 将气体通入盛饱和碳酸钠溶液的洗气瓶 | 可用于除去中CO2的HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com