
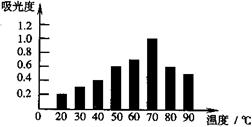
| A.20℃时,红枣中红色素含量最低 | |
| B.吸光度越大,红枣中红色素含量越高 | C.红色素可能在较高温度下不稳定 |
| D.温度越高,提取液中红色素含量越高 |
科目:高中化学 来源:不详 题型:计算题
 化工原料,工业上生产硝酸的主要过程如下:
化工原料,工业上生产硝酸的主要过程如下: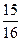 ,则N2的转化率
,则N2的转化率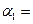 ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为 ,则
,则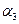
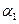 (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3 0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程) 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
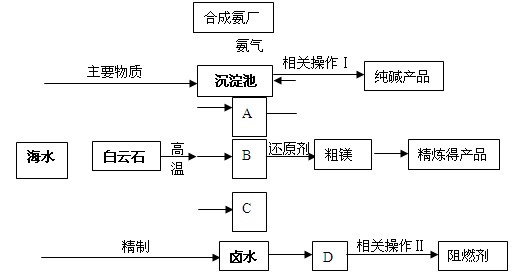
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业上用氧气在接触室中氧化黄铁矿得到二氧化硫 |
| B.工业上通过电解饱和氯化钠溶液制备金属钠 |
| C.工业用氨氧化法制硝酸是人工固氮过程 |
| D.生产普通玻璃的主要原料有石灰石、石英和纯碱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
 CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
  压强/Mpa 压强/Mpa转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
| A.保护环境。防止空气污染 | B.充分利用热量,降低生产成本 |
| C.升高温度,提高SO2的转化率 | D.防止催化剂中毒 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.正确操作步骤的顺序是⑤②③①④ |
| B.步骤④电解时阴极产生氯气 |
| C.直接在空气中将MgCl2溶液蒸干可得到Mg(OH)2高网 |
| D.此法提取镁的过程中涉及置换、分解、化合和复分解反应资 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质。 |
| B.工业制硫酸,需要在接触室的两层催化剂之间装上一个热交换器 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室,避免阳极产生的气体与烧碱反应 |
D.用铂电极电解CuSO4溶液,当Cu2+浓度降低至原来一半时,停止通电,若加入适量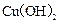 能使溶液恢复成原来浓度 能使溶液恢复成原来浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com