

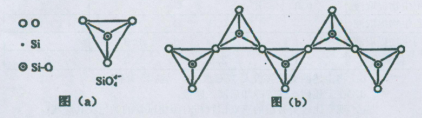
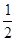 )=1:3(注意:每个结构单元中有2个氧原子与其它2个结构单元共用)。
)=1:3(注意:每个结构单元中有2个氧原子与其它2个结构单元共用)。

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+ | B.Fe2+ |
| C.Cu2+ | D.Fe3+、Fe2+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Cu+2H2SO4(浓)
| ||||
| B.C+4HNO3(浓)═CO2↑+4NO2↑+2H2O | ||||
| C.3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O | ||||
| D.CuO+H2SO4(稀)=CuSO4+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
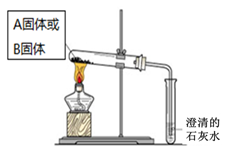
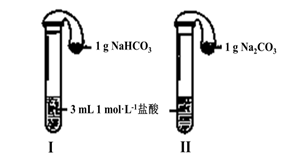
| 实验方案 | 预测现象 | 预测依据 | 实际结果 |
| 实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 | 有白色沉淀 |
| 实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 | 有白色沉淀出现,同时有少量气泡冒出。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.②③ | C.①②③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③④ | B.②③④ | C.①②③ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.太阳能电池可采用硅材料制作,其应用有利于环保、节能 |
| B.Na2SiO3可以做木材防火剂 |
| C.二氧化硅作光导纤维材料 |
| D.因为高温时二氧化硅与碳酸钠反应放出CO2,所以硅酸的酸性比碳酸强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com