
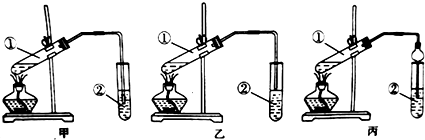
分析 【实验原理】浓硫酸有吸水性且做催化剂加快反应速率;
【装置设计】酸和乙醇易溶于水,不插入液面下是为了防止倒吸,所以选乙装置;球形干燥管导气的同时也起到防倒吸作用;
【问题讨论】混合溶液的配制一般是密度大的加到密度小的液体里,可参考浓硫酸的稀释方法来配制混合溶液;
a.实验前要先检验装置的气密性;
b.根据乙酸乙酯的物理性质分析;
c.饱和碳酸钠溶液能够除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层;
d.乙酸乙酯难溶于水.
解答 解:【实验原理】浓硫酸有吸水性,促进该反应向正反应方向移动,浓硫酸能加快反应速率,所以浓硫酸作催化剂和吸水剂,
故答案为:催化剂、吸水剂;
【装置设计】乙酸和乙醇易溶于水,不插入液面下是为了防止倒吸,所以选乙装置;球形干燥管导气的同时也起到防倒吸作用,故答案为:乙;防止倒吸;
【问题讨论】
a.实验前要先检验装置的气密性,所以连接好仪器后,加入样品前还应检查装置气密性;
故答案为:装置气密性;
b.乙酸乙酯是一种无色、不溶于水、密度比水小的液体;
故答案为:无色、不溶于水、密度比水小;
c.制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,
故答案为:溶解乙醇;中和乙酸;降低乙酸乙酯的溶解度;
d.乙酸乙酯难溶于水,在水溶液转化会分层,所以可以用分液法分离;
故答案为:分液.
点评 本题考查了乙酸乙酯的反应原理及实验室制法,题目难度不大,注意掌握乙酸乙酯的制备方法及反应原理,明确饱和碳酸钠溶液、浓硫酸在实验中的作用为解答本题的关键.


科目:高中化学 来源: 题型:多选题
| A. | 碳的燃烧热大于110.5 kJ/mol | |
| B. | ①反应的焓变为-221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
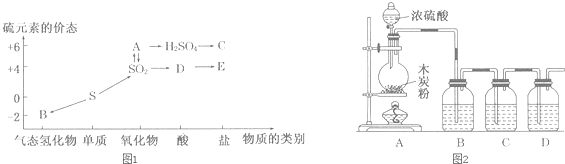
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
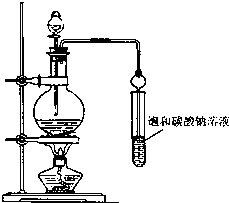 实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,直接收集蒸馏产品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗产品.据此回答问题:
实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,直接收集蒸馏产品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗产品.据此回答问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 项目 | 氨碱法 | 联合制碱法 |
| A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B. | 可能的副产物 | 氯化钙 | 氯化铵 |
| C. | 循环物质 | 氨气、二氧化碳 | 氨气、氯化钠 |
| D. | 评价 | 原料易得、产率高 | 设备简单、能耗低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
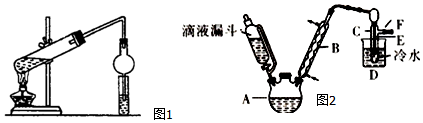
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com