
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:



| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | ||
| 2 |
| ||
| 电解 |
| ||
| 电解 |
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)按已知的原子结构规律,82号元素X应是第___________周期_________族元素,它的最高正价氧化物的化学式为______________。
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应_____________填序号),写出反应⑥的化学方程式__ __ ![]() __。
__。
(3)在下列化合物中:H2O2 、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
①只由非金属组成的离子化合物是 ,
②只有极性共价键的共价化合物是 ,
![]() ③只含有非极性共价键的是 ,
③只含有非极性共价键的是 ,
④既有离子键又有非极性键的化合物是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
 )中,既有碱性的氨基(―NH2)、又有酸性的羧基(―COOH)。在一定的酸、碱性条件下,能自身成盐(
)中,既有碱性的氨基(―NH2)、又有酸性的羧基(―COOH)。在一定的酸、碱性条件下,能自身成盐( )。所以在氨基酸分析中不能用碱溶液测定氨基酸中羧基的数目,而应先加入甲醛,使它与
)。所以在氨基酸分析中不能用碱溶液测定氨基酸中羧基的数目,而应先加入甲醛,使它与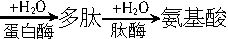 (1)化合物A的分子式为C8H15O4N3。中和1molA与甲醛反应后的产物消耗1molNaOH。1molA与HNO2反应放出1molN2 并生成B(C8H14O5N2)。B经水解后得羟基乙酸和丙氨酸。则:①A的结构简式为_______;②B的结构简式为______;③A跟甲醛反应的化学方程式为_______。
(1)化合物A的分子式为C8H15O4N3。中和1molA与甲醛反应后的产物消耗1molNaOH。1molA与HNO2反应放出1molN2 并生成B(C8H14O5N2)。B经水解后得羟基乙酸和丙氨酸。则:①A的结构简式为_______;②B的结构简式为______;③A跟甲醛反应的化学方程式为_______。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com