

| 10-13 |
| 10-11 |
| ||
| 5.4g×4mol |
| 432g |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
| A、铁壳轮船在河水中航行比在海水中航行更易被腐蚀 |
| B、常温下,铁易被干燥的氯气腐蚀 |
| C、钢铁发生吸氧腐蚀时,发生的负极反应为02+4e-+2H20═40H- |
| D、为了防止枪炮表面的钢铁被腐蚀,可以在钢铁表面进行烤蓝处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
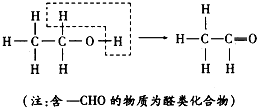
| A、(CH3)3COH |
B、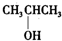 |
C、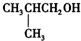 |
| D、CH3CH2CH(CH3)OH. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na和O2 |
| B、NaOH和CO2 |
| C、Na2CO3和HCl |
| D、NaHCO3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 |
| B、悬浊液中一定不含直径小于10-9m的微粒 |
| C、胶体区别于其他分散系的本质特征是胶体可发生丁达尔效应 |
| D、食盐溶液静置后会分层,下层比上层咸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com