
���� ��1����Al2��SO4��3=2Al3++3SO42-���������ǵ����ʵ�����������N=nNA��������������
��2������n=$\frac{m}{M}=\frac{N}{{N}_{A}}$���㣻
��3�������������к���10�����ӣ�����n=$\frac{m}{M}=\frac{N}{{N}_{A}}$���㣻
��4������m=nM�����������֮�ȣ���N=nNA��֪��������Ŀ֮�ȵ������ʵ���֮�ȣ�����������ԭ����ĿΪ��������2��������������ԭ����ĿΪ�������ӵ�3����
��� �⣺��1��������ʵ���Ϊx�������ӵ����ʵ���Ϊy��
��Al2��SO4��3=2Al3++3SO42-��
1 2 3
x y 3mol
��x=0.1mol��y=0.2mol��
�����ӵĸ���Ϊ0.2��NA=1.204��1023��
�ʴ�Ϊ��0.1��1.204��1023��
��2��3.4g���������ʵ���Ϊ��$\frac{3.4g}{17g/mol}$=0.2mol��0.2mol���������к���H�����ʵ���Ϊ��0.2mol��3=0.6mol������0.6NA��Hԭ�ӣ�
�ʴ�Ϊ��0.6��
��3��n��OH-��=$\frac{3.01��1{0}^{23}}{6.02��1{0}^{23}mo{l}^{-1}}$=0.5mol��m��OH-��=0.5mol��17g/mol=8.5g�����е��ӵ����ʵ���Ϊ��0.5mol��10=5mol��
n��NH3��=$\frac{8.5g}{17g/mol}$=0.5mol��
�ʴ�Ϊ��8.5�� 5mol�� 0.5��
��4������m=nM��֪����ͬ���ʵ�����O2��O3������֮��=32g/mol��48g/mol=2��3����N=nNA��֪��������Ŀ֮�ȵ������ʵ���֮��=1��1������������ԭ����ĿΪ��������2��������������ԭ����ĿΪ�������ӵ�3��������ͬ���ʵ�����O2��O3������ԭ����Ŀ֮��=1��2��1��3=2��3��
�ʴ�Ϊ��2��3��1��1��2��3��
���� ���⿼�����ʵ����ļ��㣬��Ŀ�Ѷ��еȣ���ȷ���ʵ�����Ħ������������٤��������֮��Ĺ�ϵΪ���ؼ�������������ѧ���Ļ�ѧ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 60g�������еĹ��ۼ���ĿΪ10NA | |
| B�� | ���³�ѹ�£�4.4gCO2��N2O��������к��е�ԭ����Ϊ0.3NA | |
| C�� | �ڹ���������ˮ�ķ�Ӧ�У�ÿ����0.1mol������ת�Ƶ��ӵ���ĿΪ0.4NA | |
| D�� | 80ml10mol/L����������MnO2���ȷ�Ӧ������Cl2�ķ�����Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
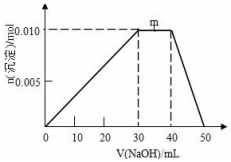 ��ʢ��10mL1mol•L-1 NH4Al��SO4��2��Һ���ձ��еμ�1mol•L-1NaOH��Һ���������ʵ�����NaOH��Һ����仯ʾ��ͼ���£�
��ʢ��10mL1mol•L-1 NH4Al��SO4��2��Һ���ձ��еμ�1mol•L-1NaOH��Һ���������ʵ�����NaOH��Һ����仯ʾ��ͼ���£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
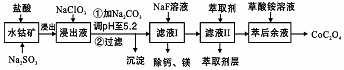
| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 | Mn��OH��2 |
| ��ȫ������pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ȼ��� | B�� | �������� | C�� | ���Ȼ��� | D�� | ������COCl2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
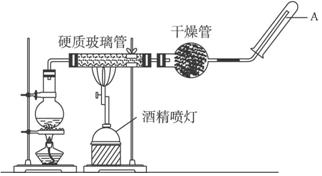 �ڳ����£�Fe��ˮ������Ӧ�����ڸ����£�Fe��ˮ�����ɷ�����Ӧ��
�ڳ����£�Fe��ˮ������Ӧ�����ڸ����£�Fe��ˮ�����ɷ�����Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 80g CuO��Cu2S�Ļ�����У�����ͭԭ����ΪNA | |
| B�� | 1mol NaBH4������ˮ��Ӧ��NaBH4+H2O��NaBO2+H2����δ��ƽ��ʱת�Ƶĵ�����Ϊ4NA | |
| C�� | �����£�2L 0.1 mol•L-1FeCl3 ��Һ�� 1L 0.2 mol•L-1FeCl3 ��Һ���� Fe3+��Ŀ��ͬ | |
| D�� | 100g��������Ϊ46%���Ҵ���Һ�к���NA��-OH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl����ˮ | B�� | �ռ������ۻ� | C�� | ������� | D�� | CaO����ˮ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com