解:(1)已知:CH
4(g)+4NO
2(g)=4NO(g)+CO
2(g)+2H
2O(g)△H
1=-574kJ?mol
-1 CH
4(g)+4NO(g)=2N
2(g)+CO
2(g)+2H
2O(g)△H
2=-1160kJ?mol
-1不管化学反应是一步完成还是分几步完成,其反应热是相同的.两式相加,可得
2CH
4(g)+4NO
2(g)=2N
2(g)+2CO
2(g)+4H
2O(g)△H=-1734 kJ/mol
即CH
4(g)+2NO
2(g)=N
2(g)+CO
2(g)+2H
2O(g)△H=-867 kJ?mol
-1故答案为:CH
4(g)+2NO
2(g)=N
2(g)+CO
2(g)+2H
2O(g)△H=-867 kJ?mol
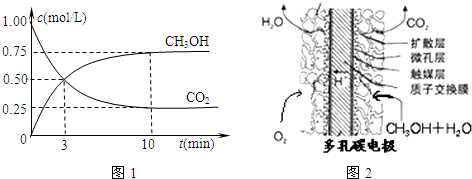
-1(2)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH
3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H
3<0.
故答案为:<
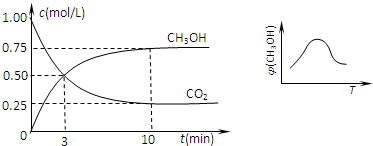
②由图2可知,开始二氧化碳的浓度为1.0mol/L,开始容器中充入1mol CO
2和3mol H
2,所以开始氢气的浓度为3.0mol/L,容器体积为
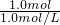
=1L.
平衡时,甲醇的浓度为0.75mol/L
CO
2(g)+3H
2(g)

CH
3OH(g)+H
2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
A、通过上述计算可知二氧化碳的转化率为
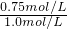
×100%=75%,再充入1mol CO
2和3mol H
2,可等效为开始体积变为原来的2倍,加入2mol CO
2和6mol H
2,平衡后,再将体积压缩为原来的体积,增大压强平衡向体积减小的方向移动,即向正反应移动,反应物的转化率增大,所以再次达到平衡时c(CH
3OH)>1.5mol/L,故A错误;
B、通过上述计算可知氢气的转化率为
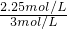
×100%=75%,故B正确;
C、10分钟内,氢气的平均反应速率为v(H
2)=

=0.225mol/(L?min),故C错误;
D、该温度下该反应的K=

=

=
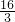
,故D错误;
E、该反应为放热反应,升高温度平衡向逆反应进行,n(CH
3OH)减小,n(CO
2)增大,所以n(CH
3OH)/n(CO
2)值减小,故E错误.
故选:B
③总反应式为2 CH
3OH+3O
2=2CO
2+4H
2O,
正极反应式:3O
2+12H
++12e
-═6H
2O;
总反应式减去正极反应式即为负极反应式,
所以负极反应式为:2CH
3OH+2H
2O-12e
-═12H
++2CO
2;
故答案为:2CH
3OH+2H
2O-12e
-═12H
++2CO
2(3)反应方程式为12NH
3+3O
2+4SO
2+4NO
2+6H
2O=4(NH
4)
2SO
4+4NH
4NO
3故答案为:12NH
3+3O
2+4SO
2+4NO
2+6H
2O=4(NH
4)
2SO
4+4NH
4NO
3分析:(1)(1)根据盖斯定律,利用已知化学反应方程式乘以某个系数相加或相减,构造出目标化学反应方程式,该化学反应的焓变即为已知化学反应方程式的焓变乘以某个系数相加或相减得到.
(2)①由图可知,到达平衡后,温度越高,φ(CH
3OH)越小,平衡向逆反应进行;
②利用三段式求出反应混合物的浓度变化量、平衡时各组分的浓度.
A、再充入1mol CO
2和3mol H
2,可等效为开始体积变为原来的2倍,加入2mol CO
2和6mol H
2,平衡后,再将体积压缩为原来的体积,增大压强平衡向体积减小的方向移动,即向正反应移动,反应物的转化率增大;
B、根据转化率的定义计算判断;
C、利用v=
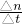
计算v(H
2)判断;
D、该温度下该反应的K=

,代入数据计算;
E、该反应为放热反应,升高温度平衡向逆反应进行,n(CH
3OH)减小,n(CO
2)增大.
③本质为 2 CH
3OH+3O
2=2CO
2+4H
2O,CH
3OH 失电子发生氧化反应,氧气得电子发生还原反应;原电池中负极上发生氧化反应,正极上发生还原反应,所以CH
3OH 在负极上发生反应,氧气在正极上发生反应;正极上氧气得电子和氢离子反应生成水;负极上CH
3OH 失电子和水反应生成氢离子和二氧化碳.
(3)根据氧化还原反应配平书写化学反应方程式.
点评:本题从多个角度对化石燃料进行了全面的考查,难度中等,培养了学生分析问题解决问题的能力.


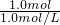 =1L.
=1L. CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)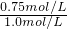 ×100%=75%,再充入1mol CO2和3mol H2,可等效为开始体积变为原来的2倍,加入2mol CO2和6mol H2,平衡后,再将体积压缩为原来的体积,增大压强平衡向体积减小的方向移动,即向正反应移动,反应物的转化率增大,所以再次达到平衡时c(CH3OH)>1.5mol/L,故A错误;
×100%=75%,再充入1mol CO2和3mol H2,可等效为开始体积变为原来的2倍,加入2mol CO2和6mol H2,平衡后,再将体积压缩为原来的体积,增大压强平衡向体积减小的方向移动,即向正反应移动,反应物的转化率增大,所以再次达到平衡时c(CH3OH)>1.5mol/L,故A错误;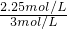 ×100%=75%,故B正确;
×100%=75%,故B正确; =0.225mol/(L?min),故C错误;
=0.225mol/(L?min),故C错误; =
= =
=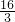 ,故D错误;
,故D错误;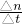 计算v(H2)判断;
计算v(H2)判断; ,代入数据计算;
,代入数据计算;

 (2011?南平二模)火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(2011?南平二模)火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.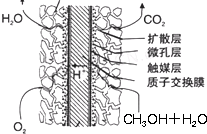
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+