
甲、乙、丙三种含不相同离子的可溶性强电解质,它们所含的离子如下表所示:
阳离子 NH4+、Na+、Mg2+
阴离子 OH﹣、NO3﹣、SO42﹣
若取等质量的甲、乙、丙配成相同体积的溶液,发现溶质的物质的量浓度c(甲)>c(乙)>c(丙),
则乙物质()
A. 可能是Na2S04 B. 可能是NH4NO3
C. 可能是NaOH D. 一定不是(NH4)2SO4
考点: 无机物的推断.
分析: 甲、乙、丙均是可溶性强电解质,则OH﹣只能与Na+组成NaOH,三种化合物不含相同离子,所以甲、乙、丙化合物有两种组合,第一组:NaOH、(NH4)2SO4、Mg(NO3)2;第二组:NaOH、NH4NO3、MgSO4,根据溶质质量相等,溶液体积相等以及物质的量浓度大小判断,相对分子质量:Mr(丙)>Mr(乙)>Mr(甲),据此判断.
解答: 解:甲、乙、丙都是可溶性强电解质,则OH﹣只能与Na+组成NaOH,三种化合物不含相同离子,所以甲、乙、丙化合物有两种组合:NaOH、(NH4)2SO4、Mg(NO3)2或NaOH、NH4NO3、MgSO4,根据溶质质量相等,溶液体积相等以及物质的量浓度大小判断,相对分子质量:Mr(丙)>Mr(乙)>Mr(甲).
第一种情况:NaOH、(NH4)2SO4、Mg(NO3)2,NaOH相对分子质量为40,(NH4)2SO4相对分子质量为132、Mg(NO3)2相对分子质量为148,
第二种情况:NaOH、NH4NO3、MgSO4,NaOH相对分子质量为40、NH4NO3相对分子质量为80、MgSO4相对分子质量为120.
所以甲为NaOH,乙可能是(NH4)2SO4或NH4NO3,丙为Mg(NO3)2或MgSO4,
故选B.
点评: 本题考查离子共存、物质的量浓度有关计算等,难度中等,明确根据离子共存判断其中一种为氢氧化钠、再进行讨论可能的物质是关键.


科目:高中化学 来源: 题型:
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l、+2.已知Cu2O与稀硫酸反应,溶液呈蓝色.现向Cu、Cu2O和CuO组成的混合物中,加入1L 0.6mol/L HNO3溶液恰好使混合物溶解,同时收集到2240mL NO气体(标准状况).请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 .
(3)若混合物中含0.1mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 .
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做()
A. 阴极 B. 阳极 C. 正极 D. 负极
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池是工作时的电池反应为:PbO2+2H2SO4⇌2PbSO4+2H2O;试回答:
(3)铅蓄电池正极的电极材料是 .
(4)工作时该铅蓄电池负极的电极反应是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知前四周期五种元素X、Y、Z、W、T,它们的原子序数依次增大.X是空气中含量最多的元素;Y、W位于同周期,W单质在常温下是黄绿色气体,Y单质在其中燃烧发出黄色火焰;Z的氧化物常用作制备通讯光纤;T是常见金属,在氧气中燃烧可以得到具有磁性的黑色物质.回答下列问题:
(1)Z位于元素周期表中第三周期第ⅣA族;W基态原子核外电子排布式为 .
(2)Y和W的简单离子比较,半径较大的是 (填离子符号);键的极性比较:X﹣H Z﹣H(填“大于”或“小于”);Z单质和其氧化物比较,熔点较高的是 (填化学式).
(3)向T单质与稀硫酸反应后的溶液中滴加足量的NaOH溶液,能观察到的现象是 ;X与Y形成的原子个数比为1:3的简单化合物可与水反应生成两种碱,写出该物质与醋酸溶液反应的化学方程式 .
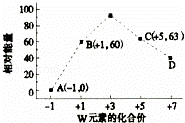
(4)一定条件下,在水溶液中1molW﹣、WO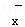 (z=1,2,3,4等)的能量(kJ)相对大小如图所示.
(z=1,2,3,4等)的能量(kJ)相对大小如图所示.
①D点对应的微粒是ClO4﹣(填离子符号).
②写出B→A+C反应的热化学方程式: (用离子符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是()
A. 任何化学反应都伴随着能量的变化
B. 1 mol H2SO4和1 mol Ba(OH)2完全反应所放出的热量称为中和热
C. 在101 kPa时,1 mol碳燃烧放出的热量就是碳的燃烧热
D. 热化学方程式未注明温度和压强时,△H表示标准状况下的数据
查看答案和解析>>
科目:高中化学 来源: 题型:
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)═2C(g),反应2min的时间,并测得该段时间内C的反应速率为0.6mol•L﹣1•min﹣1,现有下列几种说法中正确的是()
①用物质A表示的反应的平均速率为0.6mol•L﹣1•s﹣1
②用物质B表示的反应的平均速率为0.05mol•L﹣1•s﹣1
③2min时容器中A的物质的量为2.8mol
④2min时物质B的浓度为0.4mol•L﹣1.
A. ①③ B. ②④ C. ②③ D. ④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com