
| A、Mg、Cu、Na、Al |
| B、Al、Cu、Na、Mg |
| C、Cu、Na、Al、Mg |
| D、Cu、Mg、Na、Al |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
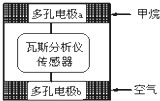 有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )| A、电极a的反应式为:CH4+4O2--8e-=CO2+2H2O |
| B、电极b是正极,O2-由电极a流向电极b |
| C、瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b |
| D、当固体电解质中有1 mol O2-通过时,电子转移4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y |
| Z |
| A、三种元素中,元素Z的最高价氧化物对应水化物的酸性最强 |
| B、单核阴离子半径的大小顺序为:r(Z)>r(Y)>r(X) |
| C、元素X和元素Z的氢化物中均只存在极性共价键 |
| D、元素X和元素Z的最高正化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑤ | B、②③④ |
| C、①③④ | D、①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量铁在氯气中反应,l mol铁失去的电子数为2 NA |
| B、标准状况下22.4 L H2中含中子数为2 NA |
| C、1 L Imol/L的盐酸溶液中,所含氯化氢分子数为NA |
| D、常温下46 g NO2和N2O4混合气体中含有原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲>乙>丙>丁 |
| B、乙>丙>丁>甲 |
| C、丁>甲>乙>丙 |
| D、丙>乙>甲>丁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com