
| A. | 20 mol•L-1•s-1 | B. | 40 mol•L-1•s-1 | C. | 60 mol•L-1•s-1 | D. | 150mol•L-1•s-1 |
分析 温度每升高10℃,化学反应速率增大到原来的2倍,初始温度为20℃,温度升高到50℃,温度变化为30℃,反应速率应是10℃的23=8倍,据此分析解答.
解答 解:温度每升高10℃,化学反应速率增大到原来的2倍,初始温度为20℃,温度升高到50℃,温度变化为30℃,反应速率应是10℃的23=8倍,所以反应的化学反应速率v(A)=8×5mol•L-1•s-1=40mol•L-1•s-1,同一可逆反应同一条件下,不同物质的反应速率之比等于其计量数之比,所以此反应的化学反应速率v(C)=$\frac{3}{2}$v(A)=$\frac{3}{2}$×40 mol•L-1•s-1=60 mol•L-1•s-1,故选C.
点评 本题考查化学反应速率有关计算,正确计算A的反应速率是解本题关键,难点是确定3是2的倍数还是指数,题目难度中等.


科目:高中化学 来源: 题型:填空题
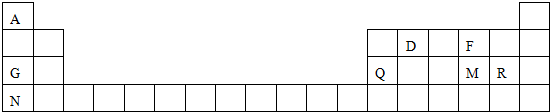
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
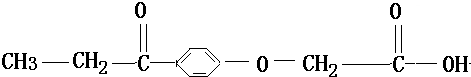
| A. | 1mol利尿酸最多可与5molH2发生加成反应 | |
| B. | 利尿酸分子中位于同一平面内的原子有10个 | |
| C. | 利尿酸分子式是C11H12O4 | |
| D. | 利尿酸与新制Cu(OH)2悬浊液反应有红色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A. | 热稳定性:正丁烷<异丁烷 | |
| B. | 乙烷燃烧的热化学方程式为: 2C2H6(g)+7O2(g)→4CO2(g)+6H2O(g)△H=-1560.8KJ/mol | |
| C. | 正戊烷的燃烧热不超过3530 KJ/mol | |
| D. | 相同质量的烷烃,碳的质量分数越大,完全燃烧放出的热量越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水提溴的过程中不发生氧化还原反应 | |
| B. | 铁的冶炼过程是利用置换反应得到单质铁 | |
| C. | 石油分馏是物理变化,可得到汽油、煤油和柴油等 | |
| D. | CO2、NO2或者SO2都会导致酸雨的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
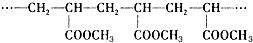
| A. | 它是缩聚反应的产物 | B. | 高分子的分子式是C4H6O2 | ||
| C. | 合成它的单体是CH2=CHCOOCH3 | D. | 高分子的相对分子质量是86 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学计量数的关系:b<c | |
| B. | 容器的容积减小后,该反应的逆反应速率减小 | |
| C. | 原容器中用B浓度变化表示该反应在1 min内的速率为$\frac{cx}{b}$mol•(L•min)-1 | |
| D. | 若保持温度和容器容积不变,充入氦气(不参与反应),平衡不发生移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com