
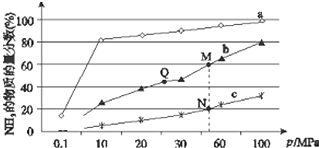
 已知合成氨反应N2(g)+3H2?NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a、b、c如图所示.下列说法正确的是( )
已知合成氨反应N2(g)+3H2?NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a、b、c如图所示.下列说法正确的是( )| A. | 曲线a对应的反应温度最高 | |
| B. | 上图中M、N、Q点平衡常数K的大小关系为K(M)=K(Q)<K(N) | |
| C. | 相同压强下,投料相同,达到平衡所需时间关系为c>b>a | |
| D. | N点时c(NH3)=0.2 mol/L,则N点的c(N2):c(NH3)=1:1 |
分析 A、正反应是放热反应,升高温度平衡逆向移动,氨气的含量减小;
B、K只受温度影响,温度不变平衡常数不变,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
C、相同压强下,投料相同,温度越高反应速率越快,达到平衡消耗时间越短;
D、N点时氨的物质的量的分数为20%,利用三段式,设N2转化率是b,N2的起始浓度为a,
根据反应N2(g)+3H2(g)?2NH3(g)
起始 a 3a 0
转化 ab 3ab 2ab
平衡 a-ab 3a-3ab 2ab
根据题意有$\left\{\begin{array}{l}{\frac{2ab}{a-ab+3a-3ab+2ab}=20%}\\{2ab=0.2mol•{L}^{-1}}\end{array}\right.$,所以a=0.3mol•L-1,b=$\frac{1}{3}$,由此分析解答.
解答 解:A、正反应是放热反应,升高温度平衡逆向移动,氨气的含量减小,而a点氨的体积分数最大,所以曲线a对应的反应温度最低,故A错误;
B、K只受温度影响,温度不变平衡常数不变,所以K(M)=K(Q),正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,Q点的温度低于N,所以K(Q)>K(N),故B错误;
C、相同压强下,投料相同,温度越高反应速率越快,达到平衡消耗时间越短,cba的温度依次降低,所以达到平衡消耗时间关系为a>b>c,故C错误;
D、N点时氨的物质的量的分数为20%,利用三段式,设N2转化率是b,N2的起始浓度为a,
根据反应N2(g)+3H2(g)?2NH3(g)
起始 a 3a 0
转化 ab 3ab 2ab
平衡 a-ab 3a-3ab 2ab
根据题意有$\left\{\begin{array}{l}{\frac{2ab}{a-ab+3a-3ab+2ab}=20%}\\{2ab=0.2mol•{L}^{-1}}\end{array}\right.$,所以a=0.3mol•L-1,b=$\frac{1}{3}$,则N点的c(N2):c(NH3)=(0.3-0.3×$\frac{1}{3}$):2×0.3×$\frac{1}{3}$=0.2:0.2=1:1,故D正确;
故选:D.
点评 本题考查了化学平衡的计算,题目难度中等,注意利用三段式进行化学平衡的计算,明确反应速率的概念及计算方法,试题培养了学生的分析、理解能力及化学计算能力.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入稀盐酸,产生无色无味且能使石灰水变浑浊的气体,该溶液一定含有CO32- | |
| B. | 用洁净的铂丝蘸取少量某溶液在无色火焰上灼烧,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中加入BaCl2溶液,有沉淀生成,再加入稀盐酸,沉淀不消失,该溶液一定含有SO42- | |
| D. | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
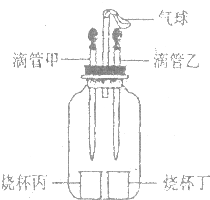 如图所示装置(气密性良好),若先将甲中液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体挤出,气球又明显鼓起.下列组合正确的是( )
如图所示装置(气密性良好),若先将甲中液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体挤出,气球又明显鼓起.下列组合正确的是( )| 选项 | 滴管甲 | 烧杯丙 | 滴管乙 | 烧杯丁 |
| A | 双氧水 | 二氧化锰 | 水 | 氢氧化钠 |
| B | 盐酸 | 镁 | 盐酸 | 碳酸纳 |
| C | 水 | 氢氧化钠 | 水 | 硝酸铵 |
| D | 水 | 氧化钙 | 盐酸 | 镁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用淀粉溶液检验溶液中是否存在碘离子 | |
| B. | 用分液漏斗分离水与乙醇的混合物 | |
| C. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| D. | 用排饱和食盐水集气法收集氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 通过红外光谱分析可以区分乙醇与乙酸乙酯 | |
| C. | 溴丙烷水解制丙醇与丙烯和水反应制丙醇属于不同反应类型 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子流向:B电极→用电器→A电极→电解质→B电极 | |
| B. | A电极上发生的一个电极反应为:2Li++S8+2e-═Li2S8 | |
| C. | 若用该电池在铁器上镀锌,电路中转移2 moI电子时,电镀池两电极质量差为65 g | |
| D. | 若用该电池电解精炼铜,负极减少7g时阳极减少质量为32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取80.0g晶体用于配制溶液 | |
| B. | 将正确称取的晶体置于预先量取的500mL水中 | |
| C. | 定容前先将烧杯中溶解得到的溶液小心地直接倾倒至500mL规格的容量瓶 | |
| D. | 正确定容后,再将容量瓶塞盖好,反复上下颠倒,摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com