
����Ŀ����֪������CH3COOH�ĵ��볣��K��1.6��10��5����20mL0.01mol��L��1 CH3COOH��Һ����μ���0.01mol��L��1KOH��Һ����pH�仯������ͼ��ʾ(�����¶ȱ仯)����ش������й����⣺
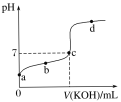
��1��д��CH3COOH�ĵ��뷽��ʽ___��
��2��c��ʱ����������������Һ�����___20ml���>����<����=������b��d����ˮ�����ӻ������Ĺ�ϵΪkw(b)___kw(d)���>����<����=�������ζ���������ѡ��___��ָʾ�����ζ��յ���___(����c������������c��������)��
��3��a����Һ��c(H��)ԼΪ___��
��4������20 mLϡ��ˮ����μ����Ũ�ȵ����ᣬ�����б仯������ȷ����____(����ĸ)��

���𰸡�CH3COOHCH3COO-+H+ < = ��̪ C������ 4��10-4mol/L B
��������
��1��CH3COOHΪ���ᣬ���뷽��ʽΪ��CH3COOHCH3COO-+H+���ʴ�Ϊ��CH3COOHCH3COO-+H+��
��2��c������ԣ����ɵĴ������ǿ�������Σ�ˮ���Լ��ԣ���c��ʱ����������������Һ�������20ml��ˮ�����ӻ�����ֻ���¶��йأ�b��d�����¶���ͬ����ˮ�����ӻ������Ĺ�ϵΪkw(b)=kw(d)���������صζ�����ǡ�÷�Ӧ���ɴ������Һ�ʼ��ԣ�Ӧѡ���̪��Һָʾ��Ӧ�յ㣬���յ�ʼ��ԣ�pH��c�����ϣ��ʴ�Ϊ��<��=����̪��C�����ϣ�
��3��c��H+��=[Ka��c(CH3COOH)]0.5= 4��10-4mol/L���ʴ�Ϊ��4��10-4mol/L��
��4����ˮ�У���ˮ��������笠����Ӻ����������ӵ�����Һ������������Ũ�ȴ��������ӣ�����ˮ��Һ�ʼ��ԣ�������Һ�����ԣ�����ˮ��Һ�м�������ʱ������Ͱ�ˮ��������кͷ�Ӧ������Һ��pHֵ���ͣ�������20mL����ʱ������Ͱ�ˮ�����ʵ�����ȣ�ǡ�÷�Ӧ�����Ȼ�泥��Ȼ����ǿ�������Σ���ˮ��Һ�����ԣ���������Һ�м����ᣬ������������������ԶԶ���ڰ�ˮ�����ʵ���ʱ����Һ������Ϊ����������Һ��pHֵ�����������pHֵ��ͼ����B���ϣ��ʴ�ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�������һ������ָ����Һ�д����������
A.ʹ��̪���ɫ����Һ��K+��Fe3+��SO42-��Cl-
B.ˮ�����c(H+)=1��10-13mol/L����Һ�У�K+��Na+��AlO2-��CO32-
C.��Al��Ӧ�ܷų�H2����Һ�У�Fe2+��Na+��NO3-��SO42-
D.![]() = 1��10-13mol/L����Һ�У�NH4+��Cu2+��Cl-��NO3-
= 1��10-13mol/L����Һ�У�NH4+��Cu2+��Cl-��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС����ʵ���Ҷ�����кͷ�Ӧ����̽��

��1���к��ȵIJⶨ����50mL 0.5mol/L ��������50mL 0.55mol/L ��NaOH��Һ����ͼ1��ʾװ���н����к��Ȳⶨ�����õ������Ũ�ȵĴ���������ᣬ����к�����ֵ____��������ƫ��������ƫС��������Ӱ������
��2���к͵ζ���ȡһ������ϡ���ᣬ��εμ�NaOH��Һ���ߵμӱ���
��ָʾ��������___________�����������ƣ�ȡһ�������ϡ��������ƿ�У��μӼ��μ�����ָʾ�����ζ��ﵽ�յ������Ϊ__________��
�ڴ����������ô�����ʵʱ�����Һ��pH���¶�������ͼ2��ʾ������Ӧ�ﵽ�յ�ʱ����Һ���¶�Ϊ____�档���õ�Ũ�ȵĴ������ϡ���ᣬ�ô�����ʵʱ�����Һ��pH��ͼ3��ʾ��ͼ2��ͼ3����Һ��ʼpH���߽ϴ��ԭ����__________��ͼ3�з�Ӧ�յ�ʱ��ҺpHԼΪ8���������ӷ���ʽ��ʾ��ԭ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ����;���Ʊ�����Ĺ��̣���Ӧ�����ԣ�������˵������ȷ���ǣ� ��

A. ;��������O2Ũ�ȿ����SO2ת����
B. ��l mol H2SO4��Ũ��Һ������NaOH��Ӧ���ų���������Ϊ�к���
C. ;������SO2��SO3����������������
D. ����Hl����H2+��H3����2H2O2��aq��=2H2O��1�� +O2��g��Ϊ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪CH4(g)+2O2(g)��CO2(g)+2H2O(g) ��H== - Q1 ��
2H2(g)+O2(g) ��2H2O(g) ��H== - Q2��
H2O(g) ��H2O(l) ��H== - Q3
�����£�ȡ�����Ϊ4��1�ļ����H2�Ļ������112L����״���£�������ȫȼ�պ�ָ������£���ų�������Ϊ
A.4Q1+0.5Q2B.4Q1+Q2+10Q3C.4Q1+2Q2D.4Q1+0.5Q2+9Q3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о��������ˮ��Һ�е�ƽ�����˽����Ĵ�����ʽ��
(1)�����£���100mL0.01molL-1HA����Һ����μ���0.02molL-1MOH��Һ��������Һ��pH��MOH��Һ������仯��ͼ��ʾ����Һ����仯���Բ��ƣ���

�ٳ����£�0.01molL-1HA��Һ����ˮ�������c��H+��=______molL-1��
�ڳ�����һ��Ũ�ȵ�MAϡ��Һ��pH=a����a__7�����������������=�����������ӷ���ʽ��ʾ��ԭ��Ϊ_______________________________________��
��X��ʱ����Һ��c��H+����c��M+����c��A�����ɴ�С��˳����___________________��
��K��ʱ����Һ��c��H+��+c��M+����c��OH����=____molL-1��
��20��ʱ����c��H2C2O4��+c��HC2O4����+c��C2O42����=0.100molL��1��H2C2O4��NaOH�����Һ�У�H2C2O4��HC2O4-��C2O42-�����ʵ�������������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ��

��Q�㣺c��H2C2O4��______c��HC2O4���������������������=����
�ڸ��¶���HC2O4-�ĵ��볣��K=___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ����
A.��״���£�![]() L��C2H4��C3H6�Ļ�����к��е�̼̼˫����ĿΪNA
L��C2H4��C3H6�Ļ�����к��е�̼̼˫����ĿΪNA
B.100g��������17%H2O2��Һ�м��Լ���ĿΪNA
C.1L0.1molK2Cr2O7��Һ�к�������������Ϊ0.2NA
D.65gZn����Ũ�����еû������ķ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ij��Ԫ��X(OH)2ˮ��Һ�������ֵ����ʵ�����������ҺpH�仯��������ͼ��ʾ������˵���������
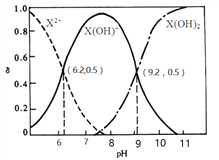
A. Kb2��������Ϊ10-8
B. X(OH)NO3ˮ��Һ�Լ���
C. �����ʵ�����X(NO3)2��X(OH)NO3�����Һ�� c(X2+)>c[X(OH)+]
D. ��X(OH)NO3ˮ��Һ�У�c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����T ��ʱ��������(Ag2CrO4)��ˮ��Һ�еij����ܽ�ƽ��������ͼ��ʾ������˵���в���ȷ���ǣ� ��

A.T ��ʱ����Y���Z�㣬Ag2CrO4��Ksp���
B.a��![]() ��10��5
��10��5
C.T ��ʱ��Ag2CrO4��KspΪ1��10��11
D.��Ag2CrO4��Һ�м������K2CrO4����ʹ��Һ��Y���ΪX��ͼ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com