
【题目】下列说法正确的是( )
A.在镀件上电镀铜时,镀件应连接电源的负极
B.粗铜电解精炼时,若电路中通过2 mol e-,阳极减少64g
C.用惰性电极电解MgCl2溶液所发生反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.用惰性电极电解饱和食盐水,阴极逸出的气体可使湿润的淀粉碘化钾试纸变蓝
【答案】A
【解析】
A、电镀时,镀件作阴极,镀层金属作阳极,镀件上镀铜,即镀件为阴极,连接电源的负极,故A正确;
B、粗铜中含有比铜活泼的金属,如Fe、Zn等,精炼铜时,粗铜作阳极,活泼金属作阳极,Zn、Fe先失电子,即电路中通过2mole-,阳极减少的质量不等于64g,故B错误;
C、用惰性材料作电极,电解MgCl2溶液,总电极反应式为Mg2++2Cl-+2H2O![]() Cl2↑+H2↑+Mg(OH)2↓,故C错误;
Cl2↑+H2↑+Mg(OH)2↓,故C错误;
D、惰性电极电解饱和食盐水,阴极上的反应式2H++2e-=H2↑,H2不能使淀粉碘化钾试纸变蓝,阳极反应式为2Cl-2e-=Cl2↑,Cl2能将I-氧化成I2,试纸变蓝,故D错误;
答案为A。


科目:高中化学 来源: 题型:
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是

A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废旧电池材料的主要成分为钴酸锂(LiCoO2),还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到Co2O3和锂盐。

已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的C2O42-离子生成Co(C2O4)n2(n-1)-而溶解。
(1)“还原酸浸”过程中,LiCoO2发生反应的离子方程式为:___,该过程温度通常控制在40℃以下的原因是:___。
(2)“除铝铁”过程的两种试剂的作用分别是___,___。
(3)“除铜”所用试剂X为H2S,试写出该反应的离子方程式:___。并计算室温下该反应的平衡常数K=___,已知:25℃时Kap(CuS)=8.5×10-45,已知H2S在水中的的电离常数:K1=1.3×10-7,K2=7.l×10-15
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

①随n(C2O42-):N(Co2+)比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因___。
②沉淀反应时间为10 min,温度在50℃以上时,随温度升高而钴的沉淀率下降的可能原因是___。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1mol·L-1,部分锂盐的溶解度数据如下表所示。

结合数据分析,沉锂过程所用的试剂b是___(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,___,___,洗涤干燥。检验沉淀洗净的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置。请回答:
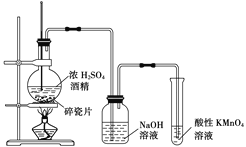
甲 乙
(1)实验步骤:
①组装仪器,检验装置的______;
②在各装置中注入相应的试剂(如图所示);
③加热,使温度迅速升到______℃;实验时烧瓶中液体混合物逐渐变黑。
(2)能够说明乙烯具有还原性的现象是:___________________________________;装置甲的作用是:____________________。若无甲装置,是否也能检验乙烯具有还原性?____,理由是:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )

A.铁被氧化的电极反应式为Fe3e=Fe3+
B.铁腐蚀过程中化学能全部转化为电能
C.一段时间后, 右侧导管液面会下降
D.活性炭的存在会加速铁的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
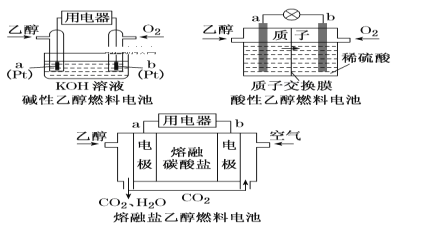
①三种乙醇燃料电池中正极反应物均为______________________;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________________;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为________。
(2)天然气既是高效洁净的能源,也是重要的化工原料。
①甲烷与氯气光照条件下的产物有多种,其中三氯甲烷(氯仿)可用作麻醉剂。氯仿分子的空间构型为_______________。
②甲烷高温分解生成氢气和炭黑。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HNO2是一种弱酸,向NaNO2中加入强酸可生成HNO2,HNO2不稳定,易分解成NO和NO2气体;HNO2是一种还原剂,能被常见的强氧化剂氧化,但在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐如NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒,可以服用维生素C解毒,维生素C在解毒的过程中表现出_____(填“氧化”或“还原”)性。
(2)下列方法中,不能用来区分NaNO2和NaCl的是(_____)
A.加入盐酸,观察是否有气泡产生
B.加入AgNO3溶液观察是否有沉淀生成
C.分别在它们的酸性溶液中加入FeCl2溶液,观察溶液颜色变化
(3)![]() 可以与Fe2+反应制备Fe2O3纳米颗粒。
可以与Fe2+反应制备Fe2O3纳米颗粒。
① 若![]() 与Fe2+的物质的量之比为1:2,配平该反应的离子方程式:
与Fe2+的物质的量之比为1:2,配平该反应的离子方程式:
___Fe2++___![]() +___H2O2+___OH-=___Fe2O3+___
+___H2O2+___OH-=___Fe2O3+___![]() +___H2O
+___H2O
② 下列关于该反应的说法中正确的是_____(填序号)。
A.该反应中![]() 表现了氧化性
表现了氧化性
B.已知生成的Fe2O3纳米颗粒直径为10纳米,则Fe2O3纳米颗粒为胶体
C.该反应中H2O2作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品添加剂必须严格按照食品安全国家标准的规定使用。作为食品添加剂中的防腐剂G可经下列反应路线得到(部分反应条件略)。则下列说法不正确的是()
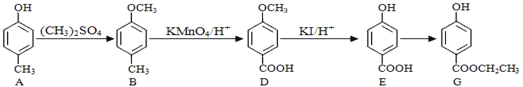
A.A与苯酚在分子组成上相差一个![]() 原子团,它们互为同系物
原子团,它们互为同系物
B.常温下A和浓溴水发生加成反应
C.经反应![]() 和
和![]() 保护的官能团是羟基
保护的官能团是羟基
D.1molE物质最多可与2molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下恒容容器中,可逆反应![]() 达到平衡状态的标志是
达到平衡状态的标志是
①单位时间内生成n mol H2的同时生成2n mol HI
②单位时间内生成n mol H2的同时,生成n molI2
③用HI、I2、H2的物质的量浓度变化表示的反应速率的比为2∶1∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的压强不再改变的状态
A.①④ .B.①④⑤ .C.①②④⑤ .D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com