
(1)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系正确的是________(填序号,下同)。
①q=2p ②q>2p
③q<2p ④无法确定
(2)若上题中的溶质是乙醇而非硫酸,则p、q的关系是________。
①q=2p ②q>2p
③q<2p ④无法确定
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
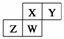
上图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( )
A.原子半径:W>Z>Y>X
B.气态氢化物的稳定性:Z>W>X>Y
C.W的最高正化合价与负化合价的绝对值可能相等
D.Z的最高价氧化物的水化物可能为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
锌片与2mol/L H2SO4反应制取氢气时,下列措施能使氢气生成速率加快的是( )
A.向反应体系中加入5mol/L的硝酸溶液提高氢离子浓度
B.将稀H2SO4改用98%浓H2SO4
C. 向反应体系中立即加入大量CuSO4溶液
D. 向反应体系中加入4.5mol/L的盐酸溶液
D. 反应进行80s时,X物质的量浓度为0.04mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)1 L水中溶解5.85 g NaCl所形成的溶液的物质的量浓度是0.1 mol·L-1 ( )
(2)将25 g CuSO4·5H2O晶体溶于29 g水中所得溶质的质量分数为25% ( )
(3)在100 mL的烧杯中,加入10 g食盐,然后注入90 mL的水,充分溶解后,所得溶质的质量分数为90% ( )
(4)将40 g SO3溶于60 g水中所得溶质的质量分数为40% ( )
(5)将62 g Na2O溶于水中,配成1 L溶液,所得溶质的物质的量浓度为1 mol·L-1
( )
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)使用托盘天平称量药品,都不能直接放在托盘中,应放两张相同的纸片 ( )
(2)定容时,往容量瓶中缓慢加蒸馏水,等液面离容量瓶刻度线1~2 mL时,改用胶头滴管滴加蒸馏水 ( )
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流( )
(2013·福建理综,10C)
(2)用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 ( )
(2013·天津理综,4B)
(3)用固体NaCl配制0.5 mol·L-1的溶液,所用的仪器有:烧杯、玻璃棒、胶头滴管、容量瓶 ( )
(2013·山东理综,11C)
(4)用 配制100 mL 0.100 0 mol·L-1 K2Cr2O7溶液 ( )
配制100 mL 0.100 0 mol·L-1 K2Cr2O7溶液 ( )
(2012·天津理综,4D)
(5)在50 mL量筒中配制0.100 0 mol·L-1碳酸钠溶液 ( )
(2012·福建理综,6C)
(6)用100 mL容量瓶、烧杯、玻璃棒、胶头滴管和pH=1的盐酸配制100 mL pH=2的盐酸 ( )
(2012·安徽理综,10B改编)
(7)用量筒量取20 mL 0.500 0 mol·L-1 H2SO4溶液于烧杯中,加水80 mL,配制成
0.100 0 mol·L-1 H2SO4溶液 ( )
(2011·江苏,7B)
(8) 定容操作 ( )
定容操作 ( )
(2010·安徽理综,8B)
(9)配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 ( )
(2010·山东理综,14B)
查看答案和解析>>
科目:高中化学 来源: 题型:
奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量)通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大 ( )
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
(2)若称取样品的质量为1.5 g,共配制100 mL的溶液,取其中的20 mL,经过一系列处理后,使N转变为硼酸铵然后用0.1 mol·L-1盐酸滴定,其用去盐酸的体积为23.0 mL,则该样品中N的含量为________(保留两位小数)。[已知:滴定过程中涉及到的反应方程式:(NH4)2B4O7+2HCl+5H2O===2NH4Cl+4H3BO3]
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
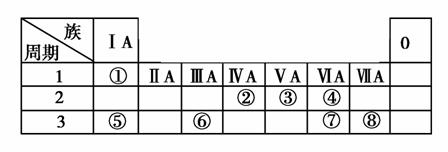
(1)请画出元素⑥的离子结构示意图:________________。
(2)元素⑦中质子数和中子数相等的同位素符号是______。
(3)④、⑤、⑦的简单离子半径由大到小的顺序为_______。
(4)②的最高价氧化物对应水化物的电离方程式为_______。
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为________________。
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为________________。
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知16 g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ热量,写出A与B反应的热化学方程式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com