
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g) ![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g) ![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若缩小反应器容积,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若缩小反应器容积,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同是( )
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有饱和碳酸钠溶液的烧杯中,插入惰性电极,接通直流电源,保持温度不变,一定时间后,
溶液中( )
A.Na2CO3浓度减小
B.Na2CO3浓度增大
C.Na2CO3浓度增大,并有晶体析出
D.Na2CO3浓度不变,并有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
请回答下列问题:
(1)上述仪器中,在配制稀盐酸时需要使用的有______________________(填序号),还缺少的仪器是______________(填仪器名称)。
(2)计算:所需浓盐酸的物质的量浓度为___________,量取浓盐酸的体积为_________mL。量取浓盐酸时应选用量筒的规格为___________。
①10 mL ②50 mL ③100 mL
(3)将所配制的稀盐酸进行测定,发现浓度大于0.8mol/L。请你分析配制过程中可能引起浓度偏高的原因(答出两点) 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,室温下分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2 和O2 的混合气体,若将H2、O2 的混合气体点燃引爆。活塞先左弹,恢复室温后,活塞右滑停留于容器的中央。则原来H2、O2 的物质的量之比可能为①4∶5 ② 2∶5 ③3∶8 ④7∶2
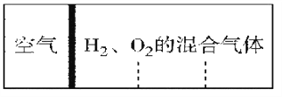
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
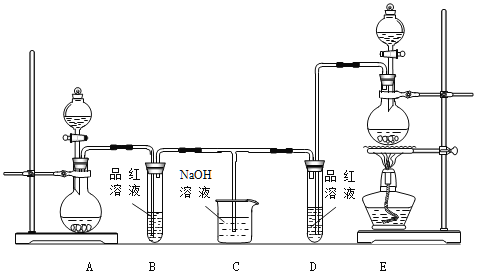
(1)他们制备Cl2依据的原理是:MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑,应选用上图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 。
MnCl2 + 2H2O + Cl2↑,应选用上图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是 。
(3)NaOH溶液分别与两种气体反应的离子方程式是 、 。
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,甲、乙两烧杯均盛有5mLpH=11的某一元碱溶液,向乙烧杯中加水稀释至pH=10。关于甲、乙两烧杯中溶液的描述不正确的是( )
A.溶液的体积:10V甲≤V乙
B.水电离出的OH-浓度:10c(H+)甲=c(H+)乙
C.若分别用等浓度的HCl溶液完全中和,所得溶液的PH:甲≤乙
D.若分别与5mLpH=3的HCl溶液反应,所得溶液的pH:甲≤乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式是 。
(2)已知:C(s)+ O2(g)![]() CO2(g) ΔH=-437.3 kJmol-1
CO2(g) ΔH=-437.3 kJmol-1
H2(g)+ ![]() O2(g)
O2(g)![]() H2O(g) ΔH=-285.8 kJmol-1
H2O(g) ΔH=-285.8 kJmol-1
CO(g)+ ![]() O2(g)
O2(g)![]() CO2(g) ΔH=-283.0 kJmol-1
CO2(g) ΔH=-283.0 kJmol-1
则煤的气化主要反应的热化学方程式是
C(s)+ H2O(g)![]() CO(g)+ H2(g) ΔH= kJmol-1。
CO(g)+ H2(g) ΔH= kJmol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com