
| A. | 100℃时,0.001mol•L-1的NaOH溶液pH=11 | |
| B. | 若溶液中c(H+)与c(OH-)相等,溶液肯定呈中性 | |
| C. | 25℃,0.001mol/LH2SO4溶液中,水电离出的c(OH-)为10-11mol/L | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
分析 A.先计算c(OH-),根据Kw=c(H+)•c(OH-)=1×10-12,计算溶液中c(H+),再利用pH=-lgc(H+)计算;
B.如果溶液中c(H+)=c(OH-),则溶液肯定呈中性;
C.根据Kw=c(H+)•c(OH-)=1×10-14,计算溶液中c(OH-),溶液中的OH-全部来自水的电离;
D.CH3COONH4为弱酸弱碱盐,促进水的电离.
解答 解:A.0.001mol•L-1NaOH溶液的c(OH-)=c(NaOH)=1×10-3mol/L,100℃时,Kw=c(H+)•c(OH-)=1×10-12,c(H+)=$\frac{1{0}^{-12}}{1{0}^{-3}}$=10-9mol/L,pH=-lgc(H+)=9,故A错误;
B.如果溶液中c(H+)=c(OH-),则溶液肯定呈中性,c(H+)>c(OH-)时溶液呈酸性,c(H+)<c(OH-)时溶液呈碱性,故B正确;
C.25℃,0.001mol/LH2SO4溶液中,c(H+)=2c(H2SO4)=0.002mol/L,水电离出的c(OH-)=$\frac{1{0}^{-14}}{0.002}$=5×10-12mol/L,故C错误;
D.CH3COONH4促进水的电离,NaCl对水的电离无影响,所以两溶液中水的电离程度不同,故D错误;
故选B.
点评 本题考查PH计算、溶液酸碱性、盐类水解、水的电离等知识点,综合性较强,溶液酸碱性要根据c(H+)、c(OH-)相对大小判断,不能根据溶液pH大小判断,易错选项是D,弱酸弱碱盐,促进水的电离,题目难度中等.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
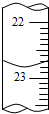 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
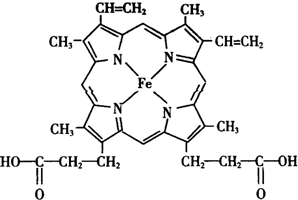 人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答:
人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答: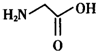 ),其分子中σ键和π键的个数比为9:1.
),其分子中σ键和π键的个数比为9:1.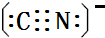 ,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).
,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10O2的酯类 | B. | 分子式为C5H10的烯烃 | ||
| C. | 分子式为C5H12O的醇类 | D. | 分子式为C5H12的所有化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
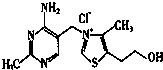 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
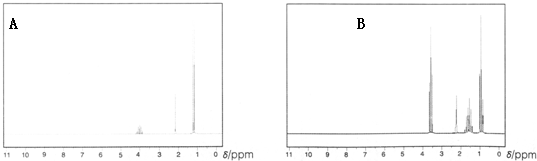
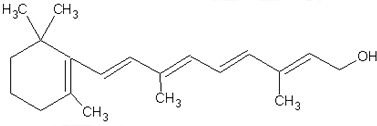
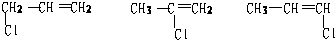 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 | |
| B. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| C. | 若AB2分子的构型为V型,则A可能为sp2杂化 | |
| D. | H2S和SO2分子中的中心原子杂化类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com