
| A. | Mg片作负极,电极反应:Mg-2e-═Mg2+ | |
| B. | Al片作负极,电极反应:Al+4OH--3e-═AlO2-+2H2O | |
| C. | 电子从Mg电极沿导线流向Al电极 | |
| D. | Al片上有气泡产生 |
分析 镁条和铝片为电极,并用导线连接同时插入NaOH溶液中,构成原电池,Al失电子作负极,Mg作正极,正极上水得电子生成氢气,电子从负极流向正极,据此分析.
解答 解:A、金属镁和氢氧化钠溶液不能发生氧化还原反应,金属铝能反应,在原电池中,失电子的一极是负极,所以金属铝是负极,故A错误;
B、金属铝是负极,负极发生失电子的氧化反应,即Al+4OH--3e-═AlO2-+2H2O,故B正确;
C、在原电池中,电子从负极流向正极,即电子从Al电极沿导线流向Mg电极,故C错误;
D、Mg作正极,正极上水得电子生成氢气,则Mg片有气泡生成,故D错误.
故选B.
点评 本题考查学生原电池的工作原理知识,注意原电池中失电子的极是负极,不一定是活泼的金属就做负极,难度不大,


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
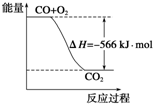 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1| A. | CO的燃烧热为283 kJ | |
| B. | 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-532 kJ•mol-1 | |
| D. | CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子 | 检验方法 |
| A | CO32- | 向样品中加入足量盐酸,将生成的无色无味的气体通入澄清石灰水中,观察溶液是否变浑浊 |
| B | SO42- | 向样品中先加入稀硝酸酸化,再滴加氯化钡溶液,观察是否有白色沉淀生成 |
| C | Fe2+ | 取少量溶液于试管中,加入酸性高锰酸钾溶液,观察溶液紫色是否褪去 |
| D | I- | 取少量溶液于试管中,加入新制氯水,再加入淀粉溶液,观察溶液是否变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不移动 | B. | 平衡左移 | C. | 平衡右移 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
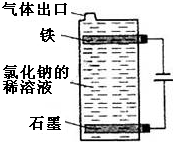 (1)按如图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;
(1)按如图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
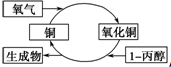
| A. | 反应中有红黑颜色交替变化的现象 | B. | 1-丙醇发生了还原反应 | ||
| C. | 生成物是丙醛和丙酮 | D. | 醇类都能发生图示的催化氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com